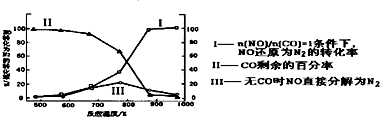
题目内容
2.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:(1)上述实验中发生反应的离子方程式有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑;
(2)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 | A | B | C | D | E | F | |
| 混 合 溶 液 | 4mol/LH2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 | |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 | |
| 时间(min) | 15 | 10 | 5 | 3 | 6 | 9 | |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降,请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)改用锌粉与稀硫酸反应,加入少量硫酸铜溶液后充分振荡,一段时间剩余少量固体.该同学对固体成分提出下列假设:
假设1:全部为铜;
假设2:既有Zn又有Cu.
(4)请你设计实验验证上述假设1,完成下表内容.
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| , |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②生成的单质Cu会沉积在Zn的表面,影响了反应速率;
(3)Zn置换出Cu,固体中一定有Cu,也可能有剩余的Zn,根据逻辑推理,假设2为Zn和Cu混合物;
(4)根据铜的金属活动性,不能置换出氢气,加入稀盐酸,如无气泡产生,则假设1成立;反之,不成立.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成CuZn微电池,加快了氢气产生的速率;
(2)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V6=10ml,V9=17.5ml,V1=30ml.
故答案为:30;10;17.5;
②因为锌会先与硫酸铜反应,直至硫酸铜反应完才与硫酸反应生成氢气,硫酸铜量较多时,反应时间较长,而且生成的铜会附着在锌片上,会阻碍锌片与硫酸继续反应,氢气生成速率下降,
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在Zn表面,降低了Zn与溶液接触的表面,使得氢气的生成速率反而下降;
(3)Zn置换出Cu,固体中一定有Cu,也可能有剩余的Zn;
故答案为:既有Zn又有Cu;
(4)根据铜的金属活动性,不能置换出氢气,加入稀盐酸,如无气泡产生,则假设1成立;反之,不成立;
故答案为:
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
| 取少量固体于试管中,滴加适量稀盐酸 | 若有气泡产生,假设1不成立; 若无气泡产生,假设2成立. |
点评 本题考查了影响化学反应速率的因素,并且融合了化学实验,形式新颖灵活,本题的易错点在于第(2)小题,首先V1、V6、V9的求得要注意分析表中数据;题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(1)硼元素是ⅢA族的第一个元素,原子结构示意图为
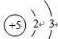 ,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.
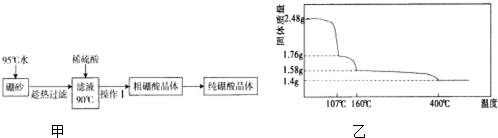
,天然硼元素有两种稳定同位素10B、11B,其相对原子质量分别为10和11,它们的相对丰度分别为20%和80%,硼元素的平均相对质量为10.8.(2)硼酸(H3BO3)是一元弱酸,工业上用硼砂(Na2B4O7•10H2O)制备硼酸晶体的流程如图甲:
不同温度下硼酸的溶解度见下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 |
| 溶解度/g | 2.7 | 5.0 | 8.7 | 14.8 | 23.8 |
②上述流程中获得粗硼酸晶体的操作Ⅰ为降温结晶(冷却热饱和溶液)、过滤,进一步将粗硼酸晶体提纯的方法是重结晶.
③25℃时0.1mol/L硼酸溶液的PH约为5.1,则其电离常数K约为10-9.2.
(3)硼酸在加热过程中发生分解的失重曲线如图乙所示.
①硼酸从开始加热到107℃时,发生反应的化学方程式为H3BO3═HBO2+H2O.
②硼酸加热到160℃得到的固体的化学式为H2B4O7.(B元素的相对原子质量按11计算)
(4)NaBH4由于H元素显-1价,具有强还原性,是有机化学上的万能还原剂.在碱性条件下电解NaBO2溶液可以制得NaBH4,其反应方程式为NaBO2+2H2O=2O2↑+NaBH4,则阴极反应式为BO2-+6H2O+8e-=BH4-+8OH-.
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 内容 | 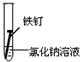 | 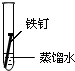 | 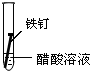 |
①在一周的观察过程中,他发现实验序号为II的试管中铁钉锈蚀速度最慢.
②下列防止钢铁锈蚀的措施不合理的是C(填字母).
A.在自行车的钢圈表面镀镍
B.改变金属内部结构制成不锈钢.
C.在地下钢铁管道上连接铜块
③炒过菜的铁锅未及时洗净(残液中含NaCl),第二天便会因腐蚀出现红褐色锈斑.试回答:铁锅的腐蚀主要是由电化学腐蚀造成的.
| A. | ②④⑤⑦ | B. | ②④⑥⑦ | C. | ①⑤⑥⑦ | D. | ②④⑥⑧ |
| X | Y | ||
| Z | W | ||
| T |
| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 含Z元素的弱酸不能与含W元素的弱酸反应得到强酸 | |
| D. | T元素形成的酸与W元素形成的酸相比,酸性一定后者弱 |
| A. | 用活性炭去除汽车内室的异味 | |
| B. | 用硝酸对钢船舱进行钝化处理 | |
| C. | 用经硫酸酸化处理的三氧化铬硅胶检验酒精 | |
| D. | 用小苏打溶水拌入面中一起蒸煮使馒头蓬松 |
 .
.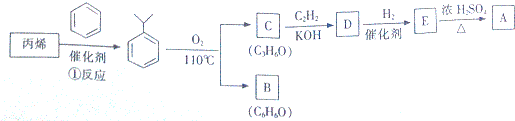
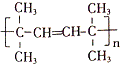 ,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.
,该反应的类型是加聚反应;B遇FeCl3溶液显紫色,B的名称是苯酚.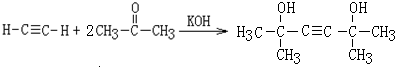 .
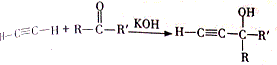
.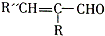 +H2O
+H2O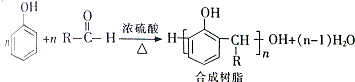
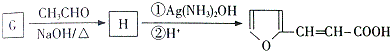
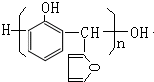 .
.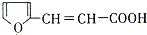 的所有同分异构体的结构简式
的所有同分异构体的结构简式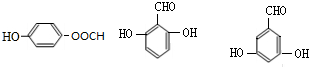 .
.