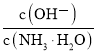题目内容
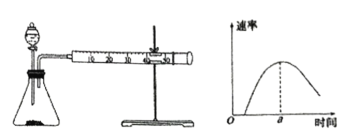
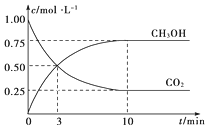
【题目】已知:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。一定条件下,向体积为1 L的密闭容器中充入1 mol CO2和3 mol H2,测得CO2和CH3OH(g)的浓度随时间的变化曲线如图所示。下列叙述中正确的是( )
A.欲增大平衡状态时![]() 的比值,可采用升高温度的方法
的比值,可采用升高温度的方法
B.3 min时,CO2的消耗速率等于CH3OH的生成速率,且二者浓度相同
C.欲提高H2的平衡转化率只能加压减小反应容器的体积
D.从反应开始到平衡,H2的平均反应速率v(H2)=0.075 mol·L-1·min-
【答案】B
【解析】
A. 该反应为放热反应,升高温度平衡向逆反应方向移动,甲醇的物质的量减少,CO2的物质的量增大,即该比值减小,故A错误;
B. 根据图像,3min时消耗CO2物质的量浓度与生成CH3OH物质的量浓度相同,根据化学反应速率数学表达式,推出3min时CO2的消耗速率等于甲醇的生成速率,且二者浓度相同,故B正确;
C. 该反应为放热反应,降低温度,促使平衡向正反应方向进行,H2的平衡转化率提高,加压,平衡向正反应方向进行,H2的转化率提高,也可以向容器中通入CO2,也可以提高H2的转化率,故C错误;
D. 根据图像,达到平衡时,甲醇的物质的量浓度为0.75mol·L-1,则消耗H2的物质的量浓度为0.75mol·L-1×3=2.25mol·L-1,v(H2)=0.225mol·L-1,故D错误;
答案:B。

 阅读快车系列答案
阅读快车系列答案【题目】含有Cu、Fe、Al、Co、Li、Si等成分的某合金废料回收利用的工艺流程如图所示。

已知:
①Fe、Co在周期表中属同周期、同族;常温下,pH=7.3时Li+或Co3+开始沉淀。
②有关物质的溶度积(Ksp):
物质 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Ksp | 4.0×10-21mol3·L-3 | 1.0×10-32mol4·L-4 | 1.0×10-38mol4·L-4 | 8.0×10-19mol3·L-3 |
回答下列问题
(1)Na2CO3溶液可作为合金废料的油污除剂,用离子方程式表示其原理__。
(2)“浸出渣”中的物质为__。
(3)①“浸出液”加入双氧水的作用是__(用离子方程式表示)。
②氨水的作用是调节溶液的pH,常温下,使溶液中杂质离子刚好沉淀完全而全部除去(浓度小于1.0×10-5mol·L-1认为完全沉淀)。需调节溶液的pH范围为__。
(4)得到的CoC2O4·2H2O晶体在空气中充分焙烧可得Co2O3,化学方程式为__。
(5)已知Li2CO3微溶于水,其饱和溶液的浓度与温度的关系如表所示。
温度/℃ | 10 | 30 | 60 |
浓度/(mol·L-1) | 0.21 | 0.17 | 0.14 |
则操作X为蒸发浓缩、__,理由是__。
【题目】对下列现象或事实的解释正确的是( )
选项 | 现象或事实 | 解释 |
A | 用热的纯碱溶液去除油污 | 纯碱与油污直接发生反应,生成易溶于水的物质 |
B | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | K2CO3与NH4Cl反应生成氨气会降低肥效 |
C | 漂白粉在空气中久置变质 | 漂白粉中的ClO-可以水解成HClO |
D | FeCl3溶液可用于水处理 | FeCl3中Fe3+具有氧化性可杀菌消毒 |
A.AB.BC.CD.D