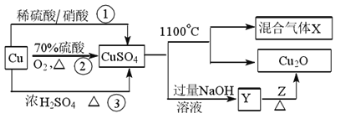
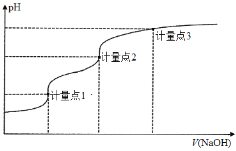
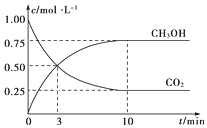
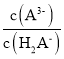题目内容
【题目】为探究化学反应速率,某小组同学做了如下实验:在两支试管中分别加入3 mL稀盐酸(均足量)(查阅资料获知,只有浓度小于1 mol·L-1的稀盐酸跟Na2CO3和NaHCO3反应才能根据反应的剧烈程度区分开来,浓度较高则反应现象都是同样的剧烈),将两个各装有0.3gNaHCO3和Na2CO3粉末的小气球分别套在两支试管口上。将气球内的NaHCO3或Na2CO3同时倒入试管中,观察到现象如下:
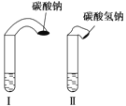
(1)试管中产生的现象为_______________________________________;
(2)试管中气球大小(包含试管)体积之比约为(填最简单整数比)Ⅰ∶Ⅱ=________;
(3)甲同学用手触摸试管,发现盛NaHCO3粉末的试管变凉,而盛Na2CO3粉末的试管温度有升高。由此他推测:NaHCO3溶液和稀盐酸反应为吸热反应,而Na2CO3溶液和稀盐酸反应为放热反应。甲得出的结论是否正确________(填“正确”或“不正确”),如不正确,请说明原因:________。
(4)另一小组同学设计实验测定碳酸钠粉末和稀盐酸反应的速率,按下列实验步骤完成实验:按下图所示安装装置,加入碳酸钠粉末,然后快速加入40mL1mol·L-1的稀盐酸,测量收集10mLCO2所用的时间。
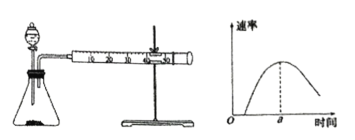
①安装装置后首先要进行的操作是_______________________。
②根据实验,该小组同学绘制产生CO2的速率如图所示,a点前反应速率逐渐增大的原因是__________;a点后速率逐渐下降的原因是_______________________。
【答案】两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多 42:53 不正确 NaHCO3反应激烈,产生CO2速度快,带出的热量快,仅根据手感来确定是不科学的,而且反应热与物质的状态有关 检查装置气密性 反应放热,加快化学反应速率 盐酸的浓度逐渐降低,反应速率减小
【解析】
⑴固体加入到盐酸中,迅速反应,NaHCO3与盐酸反应速率快。
⑵盐酸过量,0.3gNaHCO3和Na2CO3粉末物质的量之比,即为气体的体积之比。
⑶由于碳酸氢钠反应激烈,产生的二氧化碳速率快,带出的热量快,不能根据手感来判断,而且反应热与物质的状态有关。
⑷①安装发生装置后首先要进行的操作是检查装置气密性;②根据实验,该小组同学绘制产生CO2的速率如图所示,开始速率小,后来速率增大,主要由于反应是放热反应,温度升高影响速率,后来a点后速率逐渐下降的主要是盐酸的浓度降低。
⑴固体加入到盐酸中,迅速反应,因此试管中产生的现象为两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多;故答案为:两支试管中都产生大量气泡,但盛NaHCO3的试管中反应速率要快得多。
⑵盐酸过量,0.3gNaHCO3和Na2CO3粉末物质的量之比 ,由于盐酸过量,因此试管中气球大小(包含试管)体积之比等于两者物质的物质的量之比即Ⅰ∶Ⅱ=42:53;故答案为:42:53。
,由于盐酸过量,因此试管中气球大小(包含试管)体积之比等于两者物质的物质的量之比即Ⅰ∶Ⅱ=42:53;故答案为:42:53。
⑶由于碳酸氢钠与盐酸反应比碳酸钠与盐酸反应激烈,产生的二氧化碳速率快,带出的热量快,不能根据手感来判断,而且反应热与物质的状态有关,因此甲得出的结论是不正确,主要原因是NaHCO3反应激烈,产生CO2速度快,带出的热量快,仅根据手感来确定是不科学的,而且反应热与物质的状态有关;故答案为:NaHCO3反应激烈,产生CO2速度快,带出的热量快,仅根据手感来确定是不科学的,而且反应热与物质的状态有关。
⑷①气体发生装置并收集气体,则安装装置后首先要进行的操作是检查装置气密性;故答案为:检查装置气密性。
②根据实验,该小组同学绘制产生CO2的速率如图所示,开始速率小,后来速率增大,虽然浓度减小,但由于反应是放热反应,温度升高影响速率大,因此a点前反应速率逐渐增大的原因是反应放热,加快化学反应速率;后来温度虽然升高,但浓度减小且影响大,因此a点后速率逐渐下降的原因是盐酸的浓度逐渐降低,反应速率减小;故答案为:反应放热,加快化学反应速率;盐酸的浓度逐渐降低,反应速率减小。

 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定