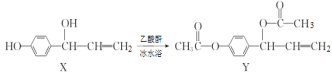
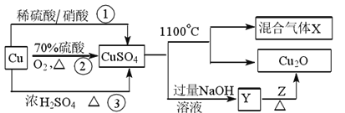
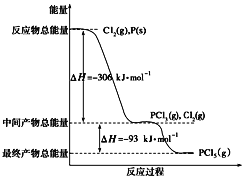
题目内容
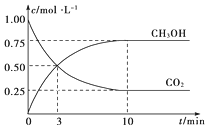
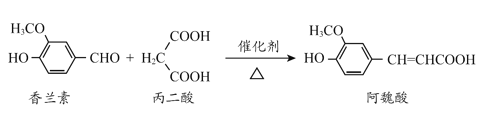
【题目】工业上可用CO2生产甲醇,反应为:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化,下列说法正确的是( )
CH3OH(g)+H2O(g)。将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化,下列说法正确的是( )

A.反应开始至a点时v(H2)=1mol·L-1·S-1
B.若曲线I对应的条件改变是升高温度,则该反应△H>0
C.曲线II对应的条件改变是降低压强
D.保持温度不变,若将平衡后的容器体积缩小至1L,重新达平衡时则2mol·L-1<c(CH3OH)<8/3mol·L-1
【答案】D
【解析】
A. 反应开始至a点时![]() ,故A错误;
,故A错误;
B. 若曲线I对应的条件改变是升高温度,氢气量增大,平衡逆向移动,即逆向是吸热反应,正反应为放热反应即反应△H < 0,故B错误;
C. 曲线II达到平衡时比实线所需时间短,反应速率快,氢气量少,说明是正向移动,则对应的条件改变是加压,故C错误;
D. 反应达到平衡时n(H2) = 2mol,则Δn(H2) = 6mol,则Δn(CH3OH) = 2mol,生成的c(CH3OH) =1 mol·L1,保持温度不变,若将平衡后的容器体积缩小至1L,则c(CH3OH) =2 mol·L1,平衡正向移动,重新达平衡时c(CH3OH) > 2 mol·L1,根据方程式关系用极限思维,8mol H2全反应生成![]() mol CH3OH,最大浓度为
mol CH3OH,最大浓度为![]() mol·L1,又由于是可逆反应,反应不完全,因此重新达到平衡2 mol·L1<c(CH3OH)<
mol·L1,又由于是可逆反应,反应不完全,因此重新达到平衡2 mol·L1<c(CH3OH)<![]() mol·L1,故D正确。
mol·L1,故D正确。
综上所述,答案为D。

练习册系列答案
相关题目