题目内容
【题目】在室温下,下列五种溶液:①0.1 mol/L NH4Cl溶液,②0.1 mol/L CH3COONH4溶液,③0.1 mol/L NH4HSO4溶液,④0.1 mol/L (NH4)2SO4,⑤0.1 mol/L氨水。请根据要求填写下列空白:
(1)溶液①呈______性(填“酸”、“碱”或“中”),其原因是____________________(用离子方程式表示)。
(2)室温下,测得溶液②的pH=7,则CH3COO-与NH4+浓度的大小关系是c(CH3COO-) ________c(NH4+)(填“>”、“<”或“=”)。
(3)上述溶液中c(NH4+)最小的是_________(填序号)。
(4)常温下,0.1 mol/ L氨水溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。
A.c(OH—) B.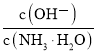
C.c(H+)·c(OH-) D.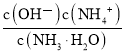
【答案】酸 NH4++H2O ![]() NH3·H2O+ H+ = ⑤ B
NH3·H2O+ H+ = ⑤ B
【解析】
(1)NH4Cl属于强酸弱碱盐,NH4+水解,使溶液显酸性;
(2)CH3COONH4属于弱酸弱碱盐,都发生水解,pH=7说明溶液显中性,用电荷守恒进行分析;
(3)利用弱电解质的电离、盐类水解程度微弱进行分析;
(4)NH3·H2O为弱碱,加水稀释促进电离进行分析;
(1)NH4Cl为强酸弱碱盐,NH4+发生水解:NH4++H2O![]() NH3·H2O+H+,造成溶液中c(H+)>c(OH-),溶液显酸性;
NH3·H2O+H+,造成溶液中c(H+)>c(OH-),溶液显酸性;
(2)根据电荷守恒,得出c(H+)+c(NH4+)=c(OH-)+c(CH3COO-),pH=7时,说明c(H+)=c(OH-),即得出c(NH4+)=c(CH3COO-);
(3)弱电解质的电离程度、盐类水解程度微弱,得出c(NH4+)大小顺序是④>③>①>②>⑤;
(4)A. NH3·H2O为弱碱,加水稀释促进电离,但c(OH-)减小,故A不符合题意;
B. 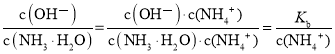 ,加水稀释,温度不变,Kb不变,c(NH4+)减小,该比值增大,故B符合题意;
,加水稀释,温度不变,Kb不变,c(NH4+)减小,该比值增大,故B符合题意;
C. c(H+)·c(OH-)=Kw,Kw只受温度的影响,因此加水稀释Kw不变,即c(H+)·c(OH-)保持不变,故C不符合题意;
D. 该比值为NH3·H2O的电离平衡常数,加水稀释,电离平衡常数不变,故D不符合题意。

 阅读快车系列答案
阅读快车系列答案