题目内容
【题目】氮氧化物是大气主要污染物,主要来自于工业废气及汽车尾气的排放,工业废气中NO是主要成分之一。
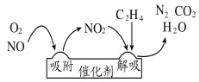
(1)乙烯作为还原剂的脱硝(NO),其反应机理示意图如图所示.写出解吸过程的化学方程式____________________。
(2)FeSO4-Na2SO3复合吸收剂吸收烟气中的NO,该方法利用Fe2+易与NO发生络合反应的特性,原理如下NO+FeSO4![]() Fe(NO)SO4
Fe(NO)SO4
①如图是一段时间内不同吸收剂对NO脱除率对比,加入Na2SO3溶液后,吸收效率增强,除了Na2SO3也能吸收部分NO外,还能防氧化从而增大Fe2+的含量,写出此原理的离子方程式_______________________________________。
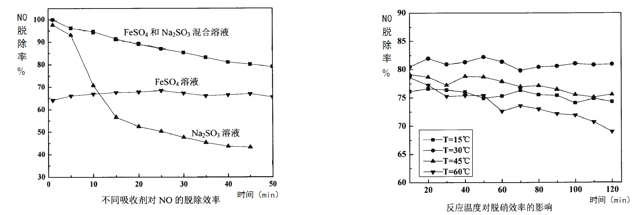
②模拟实验表明,温度过高或过低都会降低NO的脱除率,其原因是_______________________________________。
(3)采用无隔膜法电解食盐水脱氮可将氮氧化物转化成NO3-,原理如图
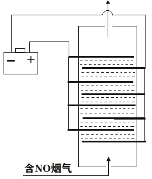
①无隔膜条件下电解食盐水后溶液呈弱碱性,原因是____________________________.
②写出NO发生反应的离子方程式____________________________。
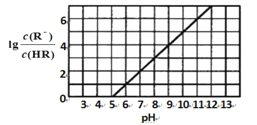
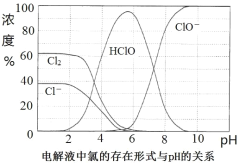
③根据下图所示,脱NO过程中控制溶液pH在______________范围内更合理。
【答案】2C2H4+6NO2![]() 4CO2+3N2+4H2O 2Fe3++SO32-+H2O=2Fe3++SO42-+2H+ 温度过低,反应速率缓慢;温度过高,NO的溶解度降低,都会造成脱除率下降 ClO-+H2O
4CO2+3N2+4H2O 2Fe3++SO32-+H2O=2Fe3++SO42-+2H+ 温度过低,反应速率缓慢;温度过高,NO的溶解度降低,都会造成脱除率下降 ClO-+H2O![]() HClO+OH- 2NO+3ClO-+2OH-
HClO+OH- 2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O 5—6
2NO3-+3Cl-+2H2O 5—6
【解析】
(1)反应机理示意图如图所示,解吸过程反应物为C2H4,NO2生成物为CO2、N2、H2O ,写出对应化学方程式;
(2)①Na2SO3具有还原性,Fe3+具有氧化性,两者发生氧化还原反应,能防Fe2+氧化从而增大Fe2+的含量;
②温度过低,反应速率缓慢,温度过高,NO的溶解度降低;
(3)①电解食盐水,阳极失去电子,反生为2Cl--2e-=Cl2↑,阴极得到电子,反生的反应为2H2O+2e-=2OH-+H2↑,总反应方程式为Cl-+ H2O= ClO-+H2↑,ClO-会水解;
②ClO-作氧化剂,NO为还原剂,在碱性条件下的反应为2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O;
2NO3-+3Cl-+2H2O;
③根据图分析,当pH介于5-6时,Cl元素以HClO存在,此时氧化性最强。
(1)反应机理示意图如图所示,解吸过程反应物为C2H4,NO2生成物为CO2、N2、H2O ,化学方程式为2C2H4+6NO2![]() 4CO2+3N2+4H2O,故答案为:2C2H4+6NO2
4CO2+3N2+4H2O,故答案为:2C2H4+6NO2![]() 4CO2+3N2+4H2O;
4CO2+3N2+4H2O;
(2) ①Na2SO3具有还原性,Fe3+具有氧化性,两者发生氧化还原反应,能防Fe2+氧化从而增大Fe2+的含量,离子方程式为2Fe3++SO32-+H2O=2Fe3++SO42-+2H+,故答案为:2Fe3++SO32-+H2O=2Fe3++SO42-+2H+;
②温度过低,反应速率缓慢,温度过高,NO的溶解度降低,故答案为:温度过低,反应速率缓慢;温度过高,NO的溶解度降低,都会造成脱除率下降;
(3)①电解食盐水,阳极失去电子,反生为2Cl--2e-=Cl2↑,阴极得到电子,反生的反应为2H2O+2e-=2OH-+H2↑,总反应方程式为Cl-+ H2O= ClO-+H2↑,ClO-会发生水解,方程式为ClO-+H2O![]() HClO+OH-,故答案为:ClO-+H2O
HClO+OH-,故答案为:ClO-+H2O![]() HClO+OH-;
HClO+OH-;
②ClO-作氧化剂,NO为还原剂,在碱性条件下的反应为2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O,故答案为:2NO+3ClO-+2OH-
2NO3-+3Cl-+2H2O,故答案为:2NO+3ClO-+2OH-![]() 2NO3-+3Cl-+2H2O;
2NO3-+3Cl-+2H2O;
③根据图分析,当pH介于5-6时,Cl元素以HClO存在,此时氧化性最强,故答案为5-6。