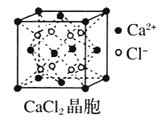
题目内容
【题目】氢氧化铈[Ce(OH)4]被广泛用于气敏传感器、燃料电池、催化剂等领域。实验室以精选的氟碳铈矿(主要成分为CeFCO3 )为原料制备氢氧化铈的一种工艺流程如下:
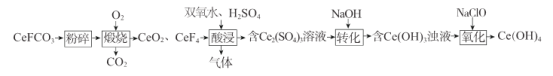
回答下列问题:
(1)“煅烧”可在_______(填仪器名称)中进行,主要反应的化学方程式为________;除“粉碎”外,还可以加快“煅烧”速率的措施有_________(只答一点即可)。
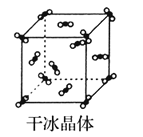
(2)实验室制取氧气。
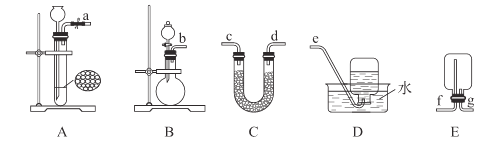
①氧气的发生装置可以选择上图中的__________(填大写字母)。
②欲收集一瓶干燥的氧气,选择上图中的装置,按气流方向的连接顺序为:氧气的发生装置→________(填小写字母);检验氧气已收集满的操作和现象为________。
(3)“酸浸”时,温度不能过高的原因为_______;若用盐酸代替双氧水、H2SO4的不足之处为____________;该步骤不能使用陶瓷容器的原因为___________________。
(4)“氧化”反应的化学方程式为_________________________________。
【答案】坩埚 4CeFCO3+O2![]() 3CeO2+CeF4+4CO2 适当升高煅烧温度等 B cdgf(或dcgf) 将带有火星的木条置于f口,木条复燃 会导致H2O2分解而降低原料的利用率 HCl被氧化为Cl2,污染环境 生成的HF腐蚀陶瓷 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
3CeO2+CeF4+4CO2 适当升高煅烧温度等 B cdgf(或dcgf) 将带有火星的木条置于f口,木条复燃 会导致H2O2分解而降低原料的利用率 HCl被氧化为Cl2,污染环境 生成的HF腐蚀陶瓷 2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl
【解析】
将氟碳铈矿粉碎后与O2在坩埚中高温煅烧,反应产生CeO2、CeF4、CO2,然后将CeO2、CeF4用硫酸浸取,同时加入H2O2溶液,可以将CeO2、CeF4与硫酸反应产生的Ce4+还原为Ce3+,向该溶液中加入适量NaOH溶液反应产生Ce(OH)3,然后再向该悬浊液中加入氧化剂NaClO,发生氧化还原反应产生Ce(OH)4。
(1)高温“煅烧”可在坩埚中进行;CeFCO3高温条件下与O2反应生成CeO2、CeF4、CO2,根据电子守恒、原子守恒,可得该反应的反应方程式为4CeFCO3+O2![]() 3CeO2+CeF4+4CO2。除“粉碎”外,还可以加快“煅烧”速率的措施有适当增大O2的压强、适当升高煅烧温度等;
3CeO2+CeF4+4CO2。除“粉碎”外,还可以加快“煅烧”速率的措施有适当增大O2的压强、适当升高煅烧温度等;
(2)①用双氧水与MnO2或Na2O2与H2O反应制备O2可选择装置B装置,故合理选项是B;
②选用B装置制备O2,用C干燥O2,E用于收集O2,故装置的连接顺序为bcd(或dc)gf;检验O2收集满的操作和现象为:将带火星的木条置于f口,木条复燃,则O2已经收集满;
(3) H2O2不稳定,受热易分解,所以“酸浸”时,温度不易过高,否则会导致H2O2分解,降低原料的利用率;若用盐酸代替,Ce4+会将HCl被氧化为Cl2,导致污染环境;该步骤有HF生成,由于HF与陶瓷中的SiO2会反应,故不能使用陶瓷容器;
(4) “氧化”时NaClO在碱性条件下将Ce(OH)3氧化为Ce(OH)4,反应的化学方程式为2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl。

 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案【题目】如图是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是( )

氯化钠 (NaCl) | ≥98.0% (以NaCl计) |
碘酸钾 (KIO3) | (35±15)mg/kg (以I计) |
A.此食盐是纯净物
B.“加碘食盐”中的“碘”是指单质
C.1kg此食盐中含碘酸钾(35±15)mg
D.菜未烧熟不宜加入加碘的原因可能是碘酸钾受热不稳定