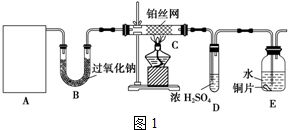
题目内容
18.下列关于有机物的说法中,正确的是( )| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图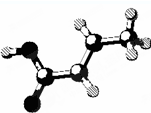 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |
分析 A.苯和溴苯都不溶于水,但苯密度小于水,溴苯密度大于水;
B.苯能燃烧而发生氧化反应;
C.聚乙烯中不含碳碳双键,不能被酸性高锰酸钾溶液氧化;
D.根据原子成键特点知该有机物结构简式为CH3CH=CHCOOH,含有碳碳双键和羧基,具有烯烃和羧酸性质.
解答 解:A.苯和溴苯都不溶于水,但苯密度小于水,溴苯密度大于水,所以苯、溴苯分别和水混合时,苯位于水的上方、溴苯位于水的下方,现象不同,可以鉴别,故A错误;
B.苯不能被酸性高锰酸钾溶液氧化,但能燃烧而发生氧化反应,故B错误;
C.聚乙烯中不含碳碳双键,不能被酸性高锰酸钾溶液氧化,所以聚乙烯不能使酸性高锰酸钾溶液褪色,故C错误;
D.根据原子成键特点知该有机物结构简式为CH3CH=CHCOOH,含有碳碳双键和羧基,具有烯烃和羧酸性质,能发生加成反应、取代反应、酯化反应,故D正确;
故选D.
点评 本题考查有机物的结构性质、有机物鉴别等知识点,明确有机物官能团及其性质关系是解本题关键,利用物质的差异性进行鉴别,易错选项是C.

练习册系列答案
相关题目
8.下面是元素周期表的一部分.下列与表中元素有关的叙述正确的是( )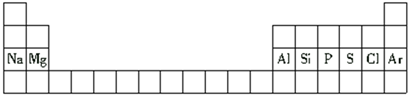

| A. | 铝是第二周期元素 | |
| B. | 氯原子的半径比硫原子的半径小 | |
| C. | 氢氧化钠的碱性比氢氧化镁的碱性弱 | |
| D. | 硅原子的最外层电子数比磷原子的最外层电子数多 |
13.下列各组离子在指定溶液中能大量共存的是( )
| A. | 无色溶液:K-、Na+、Cu2+、OH- | |
| B. | 由水电离出的c(OH-)=10-13mol/L的溶液中:Na+、Ba2+、Cl-、Br+- | |
| C. | 加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
3.下列叙述正确的是( )
| A. | Fe与S混合加热生成FeS2 | |
| B. | NaHCO3的热稳定性大于Na2CO3 | |
| C. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| D. | Fe在足量Cl2中燃烧生成和FeCl2和FeCl3 |
10.某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各离子浓度的关系错误的是( )
| A. | c (Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | B. | c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | c (Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) | D. | c(Na+)=c(HA-)+c(HA)+2c(A2-) |
7.下列各项中指定的比值为2:1的是( )
| A. | 相同温度下,2 mol•L-1的醋酸溶液与1 mol•L-1的醋酸溶液中的c(H+)之比 | |
| B. | H2CO3水溶液中c(H+)与c(CO32-)之比 | |
| C. | Na2CO3溶液中c(Na+)与c(CO32-)之比 | |
| D. | 常温下,0.1 mol•L-1Na2CO3溶液与0.1 mol-1CH3COONa溶液中c(Na+)之比 |