题目内容
8.A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素.试回答:(1)B元素在周期表中的位置为第二周期ⅤA族;
(2)将D的单质投入A2C中,反应后得到一种无色溶液.E的单质在该无色溶液中反应的离子方程式为2Al+2H2O+2OH-=2AlO2-+3H2↑.
(3)经测定,A2C2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式H2O2═H++HO2-.过去常用硫酸处理BaO2来制备制备A2C2,写出该反应的离子方程式BaO2+2H++SO42-=BaSO4↓+H2O2;
现在实验室可以将过氧化钠加入到水中来制取A2C2,写出该反应的化学方程式Na2O2+2H2O=2NaOH+H2O2;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解.现改用A2C2和稀硫酸浸泡废印刷电路板既达到了上述目的,又保护了环境,试写出反应的离子方程式H2O2+H2SO4+Cu=CuSO4+2H2O.
(5)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃.
①DA能与水反应放氢气,反应化学方程式是NaH+H2O=NaOH+H2↑.
②若将1mol DA和1mol E单质混合加入足量的水,生成气体的体积是 (标准状况下)56L.
分析 A、B、C、D、E为短周期元素,A到E原子序数依次增大.E是地壳中含量最多的金属元素,则E为Al;A、C能形成两种液态化合物A2C和A2C2,则A为H,C为O;A、D同主族,由A、D的原子序数相差大于2,所以D为Na;元素的质子数之和为40,则B的原子序数为40-1-8-11-13=7,所以B为N,据此解答.
解答 解:A、B、C、D、E为短周期元素,A到E原子序数依次增大.E是地壳中含量最多的金属元素,则E为Al;A、C能形成两种液态化合物A2C和A2C2,则A为H,C为O;A、D同主族,由A、D的原子序数相差大于2,所以D为Na;元素的质子数之和为40,则B的原子序数为40-1-8-11-13=7,所以B为N.
(1)B为N,位于元素周期表中第二周期ⅤA族,故答案为:第二周期ⅤA族;
(2)Na与水反应生成NaOH,Al与NaOH溶液反应的离子反应为:2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案为:2Al+2H2O+2OH-=2AlO2-+3H2↑;
(3)A2C2为H2O2,为二元弱酸,其酸性比碳酸的还要弱,第一步电离的电离方程式为:H2O2═H++HO2-,用硫酸处理BaO2来制备制备H2O2,该反应的离子方程式为:BaO2+2H++SO42-=BaSO4↓+H2O2,将过氧化钠加入到水中来制取H2O2,该反应的化学方程式为:Na2O2+2H2O=2NaOH+H2O2,
故答案为:H2O2═H++HO2-;BaO2+2H++SO42-=BaSO4↓+H2O2;Na2O2+2H2O=2NaOH+H2O2;
(4)A2C2为H2O2,与Cu、硫酸发生氧化还原反应生成硫酸铜和水,该反应为H2O2+H2SO4+Cu=CuSO4+2H2O,
故答案为:H2O2+H2SO4+Cu=CuSO4+2H2O;
(5)钠的单质在一定条件下能与氢气化合生成一种氢化物NaH,熔点为800℃,属于离子化合物.
①NaH能与水反应放氢气,反应化学方程式是:NaH+H2O=NaOH+H2↑,
故答案为:NaH+H2O=NaOH+H2↑;
②由NaH+H2O=NaOH+H2↑,可知1molNaH反应生成1molNaOH、1mol氢气,由2Al+2H2O+2OH-=2AlO2-+3H2↑,可知1mol与1mol氢氧化钠恰好反应,生成氢气为1mol×$\frac{3}{2}$=1.5mol,故生成气体的体积是:(1mol+1.5mol)×22.4L/mol=56L,
故答案为:56.
点评 本题考查位置结构性质的关系及应用,推断元素是解答本题的关键,熟练掌握物质的性质及化学反应方程式的书写,题目难度中等.

| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图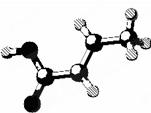 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |
| A. | 常温常压下,4.6 g NO2气体约含有1.81×1023个原子 | |
| B. | 在标准状况下,80 gSO3所占的体积约为22.4L | |
| C. | 常温下,0.1 mol/L醋酸溶液的pH约为1 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |
| A. | O原子的电子排布图为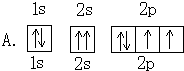 | |
| B. | 氯化钠的分子式:NaCl | |
| C. | Cl-的结构示意图: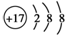 | |
| D. | Ca原子的电子排布式为 1s22s22p63s23p63d2 |
( )

| A. | C70的熔点比石墨的熔点低 | |
| B. | C70和金刚石是同素异形体 | |
| C. | C70分子中含有70个σ键,35个π键 | |
| D. | C70Cl10分子中共用电子对数目为145个 |
| A. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 洗涤沉淀时,应在过滤器中加入洗涤液浸没沉淀,过滤,并重复2到3次 | |
| C. | 抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶支管口倒出 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |
| A. | 分离KNO3和氯化钠,常用结晶与重结晶 | |
| B. | 分离溴苯和水,常用蒸馏法 | |
| C. | 提纯含有碘的食盐,常用升华法 | |
| D. | 苯和酸性高锰酸钾溶液可用分液法 |
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示) .
.