题目内容
8.下面是元素周期表的一部分.下列与表中元素有关的叙述正确的是( )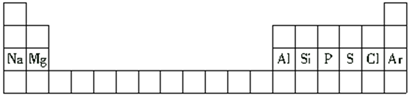
| A. | 铝是第二周期元素 | |
| B. | 氯原子的半径比硫原子的半径小 | |
| C. | 氢氧化钠的碱性比氢氧化镁的碱性弱 | |
| D. | 硅原子的最外层电子数比磷原子的最外层电子数多 |
分析 A.由Al在周期表装置,可知其处于第三周期;
B.同周期自左而右原子半径减小;
C.同周期自左而右金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强;
D.同周期主族元素自左而右最外层电子数增大.
解答 解:A.由Al在周期表装置,可知其处于第三周期,故A错误;
B.同周期自左而右原子半径减小,故原子半径:Cl<S,故B正确;
C.同周期自左而右金属性减弱,金属性越强,最高价氧化物对应水化物的碱性越强,故碱性:氢氧化钠>氢氧化镁,故C错误;
D.硅原子的最外层电子数比磷原子的最外层电子数少,故D错误,
故选B.
点评 本题考查的是元素周期表和元素周期律的知识,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
15.根据下表(部分短周期元素的原子半径及主要化合价)信息,判断以下叙述正确的是( )
| 元素代号 | A | B | C | D | E | F |
| 原子半径/nm | 0.186 | 0.143 | 0.160 | 0.102 | 0.074 | 0.099 |
| 主要化合价 | +l | +3 | +2 | +6、-2 | -2 | +7、-1 |
| A. | 元素D位于第三周期Ⅵ族 | |
| B. | A、B、C三种元素的最高价氧化物对应水化物的碱性依次增强 | |
| C. | 1mol F的单质参加氧化还原反应时转移的电子数一定为2 mol | |
| D. | 元素B、E形成的化合物具有两性 |
16.下列有关说法不正确的是( )
| A. | 苯中碳碳键是介于C-C和C=C之间的一种特殊共价键 | |
| B. | 甲烷、乙烯都能使酸性KMnO4溶液褪色 | |
| C. | 葡萄糖溶液中加入银氨溶液,水浴加热有银镜生成 | |
| D. | 医用酒精能使蛋白质变性,可用于消毒杀菌 |
13.NA表示阿伏伽德罗常数,则下列叙述中,正确的是( )
| A. | 32g S2-中电子数目为2NA | |
| B. | 46g NO2和N2O4的混合物中含有的原子数为3NA | |
| C. | 1L 0.5mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | 78g Na2O2中阴离子数目为2NA |
3.在恒温恒容条件下,向容积为2L的密闭容器中充人2mol SO2和2mol O2,已知:2SO2(g)+O2(g)?2SO2(g);△H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25a kJ.下列判断正确的是( )
| A. | 在1 min时:c(SO3)+c(SO2)=1.0mol/L | |
| B. | 2 min 内:v(SO2)=0.25mol/(L•min) | |
| C. | 若再充入2mol SO3,达平衡时SO3%(质量分数)减小 | |
| D. | 反应条件相同,若起始时向反应容器中充入2mol SO3,平衡时反应吸热0.75a kJ |
13.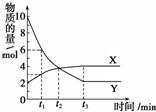 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
 一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )
一定温度下在2L容器内进行某一反应,气体X、气体Y的物质的量随反应时间变化的曲线如图.下列叙述中正确的是( )| A. | 反应的化学方程式为4X?Y | |
| B. | t2时,正反应速率等于逆反应速率 | |
| C. | t3时,Y浓度不再变化,反应达到平衡 | |
| D. | 当t1=2时,用X表示该反应在2 min内的平均反应速率为0.25mol/(L•min) |
17.如图为某化学反应的能量-反应进程图,由此可判断该反应( )


| A. | 为放热反应 | B. | 为吸热反应 | C. | 属于燃烧反应 | D. | 属于中和反应 |
18.下列关于有机物的说法中,正确的是( )
| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图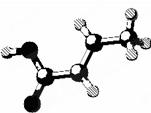 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |