题目内容
10.某二元弱酸的酸式盐NaHA溶液,若pH<7,则溶液中各离子浓度的关系错误的是( )| A. | c (Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | B. | c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-) | ||
| C. | c (Na+)>c(HA-)>c(OH-)>c(A2-)>c(H+) | D. | c(Na+)=c(HA-)+c(HA)+2c(A2-) |
分析 某二元弱酸的酸式盐NaHA溶液,若pH<7,溶液呈酸性,说明HA-电离程度大于其水解程度,则c(H+)>c(OH-);由于氢离子来自水的电离和
HA-的电离,则c(H+)>c(A2-),溶液中离子浓度大小为:c (Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-);溶液中还存在电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-)、物料守恒:(Na+)=c(HA-)+c(HA)+c(A2-),结合电荷守恒、电荷守恒对各选项进行判断.
解答 解:某二元弱酸的酸式盐NaHA溶液,若pH<7,说明溶液呈酸性,HA-电离程度大于其水解程度,
A.溶液中HA-离子电离程度大于水解程度,离子浓度大小为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故A正确;
B.溶液中存在电荷守恒:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故B正确;
C.根据A的分析可知,溶液中离子浓度大小为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C错误;
D.根据物料守恒可得:c(Na+)=c(HA-)+c(HA)+c(A2-),故D错误;
故选CD.
点评 本题考查了溶液中离子浓度大小分析,题目难度中等,明确电荷守恒、物料守恒为解答关键,能够利用电荷守恒、物料守恒及盐的水解比较溶液中离子浓度大小.

练习册系列答案
相关题目
1.下列说法中错误的是( )
| A. | SO2、SO3都是极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
18.下列关于有机物的说法中,正确的是( )
| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图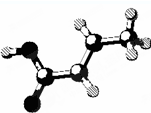 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |
5.常温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | 氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) | |
| B. | pH=2的一元酸和pH=12的一元强碱等体积混合:c(OH-)=c(H+) | |
| C. | 0.1 mol•L-1的硫酸铵溶液中:c(NH4+)>c(SO42-)>c(H+) | |
| D. | 0.1 mol•L-1的硫化钠溶液中:c(OH-)=c(H+)+c(HS-)+c(H2S) |
15.下列实验操作或实验所得出的结论一定正确的是( )
| A. | 制备Fe(OH)3胶体时,应往沸水中逐滴加lmol•L-l的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 | |
| B. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 用托盘天平准确称取5.85g NaCl固体 |
2.下列各组中互为同位素的是( )
| A. | ${\;}_{19}^{40}$K与${\;}_{20}^{40}$Ca | B. | 正丁烷与异丁烷 | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
20.下列实验操作不正确的是( )
| A. | 用倾析法分离时,将烧杯中的上层清液用玻璃棒引流到另一容器内,即可使沉淀与清液分离 | |
| B. | 洗涤沉淀时,应在过滤器中加入洗涤液浸没沉淀,过滤,并重复2到3次 | |
| C. | 抽滤完毕,应先拆下连接抽气泵和吸滤瓶的橡胶管,再关闭水龙头,最后将滤液从吸滤瓶支管口倒出 | |
| D. | 用移液管取液后,将移液管垂直放入稍倾斜的容器中,并使管尖与容器内壁接触,松开食指使溶液全部流出,数秒后,取出移液管 |