题目内容
6.请将6种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3 H2O分别填入下面对应的横线上,组成一个配平的化学方程式:方程式为:(1)30HNO3+24FeSO4→8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O
(2)反应物中发生氧化反应的物质是FeSO4,被还原的元素是N.
(3)反应中1mol氧化剂发生还原时转移电子数为4mol.
分析 (1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,硫酸亚铁中二价铁离子被氧化生成三价铁离子,为还原剂,对应氧化产物为硫酸铁和硝酸铁,根据氢原子守恒,水在生成物中,根据化合价升降相等和原子守恒配平后发生的反应,据此解答;
(2)反应物中所含元素化合价升高的物质被氧化;所含元素化合价降低的被还原;
(3)根据化合价变化数目计算1mol氧化剂发生还原时转移电子数.
解答 解:所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,硫酸亚铁中二价铁离子被氧化生成三价铁离子,为还原剂,对应氧化产物为硫酸铁和硝酸铁,依据原子个数守恒、得失电子守恒可知,该反应的化学方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,
故答案为:30HNO3;24FeSO4;8Fe(NO3)3;8Fe2(SO4)3;3N2O;15H2O;
(2)依据方程式:30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,可知:硫酸亚铁中的二价铁离子化合价升高,所以硫酸亚铁被氧化;
硝酸中N元素化合价,被还原;
故答案为:FeSO4;N;
(3)30HNO3+24FeSO4=8Fe(NO3)3+8Fe2(SO4)3+3N2O+15H2O,硝酸为氧化剂,由方程式可知:
HNO3~0.5N2O~转移电子数4,
1mol 4mol;
故答案为:4.
点评 本题考查了化学方程式书写,侧重考查氧化还原方程式的书写,依据物质的性质及氧化还原反应的强弱规律判断反应物与生成为解题关键,注意对基本概念的掌握.

练习册系列答案
相关题目
13.NA表示阿伏伽德罗常数,则下列叙述中,正确的是( )
| A. | 32g S2-中电子数目为2NA | |
| B. | 46g NO2和N2O4的混合物中含有的原子数为3NA | |
| C. | 1L 0.5mol•L-1 Na2CO3溶液中含有的CO32-数为0.5NA | |
| D. | 78g Na2O2中阴离子数目为2NA |
17.如图为某化学反应的能量-反应进程图,由此可判断该反应( )


| A. | 为放热反应 | B. | 为吸热反应 | C. | 属于燃烧反应 | D. | 属于中和反应 |
14.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续滴加氨水,难溶物溶解得到深蓝色透明溶液.若加入乙醇将析出深蓝色晶体.下列说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3提供孤对电子 | |
| C. | 沉淀溶解后将生成深蓝色的正四面体形的配离子[Cu(NH3)4]2+ | |
| D. | 加入极性较小的溶剂乙醇后,将析出[Cu(H2O)4]SO4•H2O晶体 |
1.下列说法中错误的是( )
| A. | SO2、SO3都是极性分子 | |
| B. | 在H3O+和[Cu(H2O)4]2+中都存在配位键 | |
| C. | 元素电负性越大的原子,该元素的原子吸引键合电子的能力越强 | |
| D. | 原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
11.下列关于化学键和分子间作用力的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 一种物质只含两种非金属元素,该物质中一定没有非极性供价键 | |
| D. | 氢键属于分子间作用力,不属于化学键 |
18.下列关于有机物的说法中,正确的是( )
| A. | 用水不能鉴别苯和溴苯 | |
| B. | 苯不能使KMnO4溶液褪色,因此苯不能发生氧化反应 | |
| C. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| D. | 某有机物的分子结构如图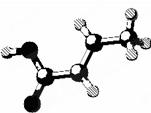 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 (图中棍表示单键、双键或叁键),它属于烃的含氧衍生物,该有机物可发生取代反应和加成反应 |
15.下列实验操作或实验所得出的结论一定正确的是( )
| A. | 制备Fe(OH)3胶体时,应往沸水中逐滴加lmol•L-l的FeCl3溶液,并继续加热到液体呈透明的红褐色为止 | |
| B. | 加热NH4Cl晶体时,用湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| C. | 将金属钠在研钵中研成粉末,使钠与水反应的实验更安全 | |
| D. | 用托盘天平准确称取5.85g NaCl固体 |
16.下列叙述正确的是( )
| A. | 常温常压下,4.6 g NO2气体约含有1.81×1023个原子 | |
| B. | 在标准状况下,80 gSO3所占的体积约为22.4L | |
| C. | 常温下,0.1 mol/L醋酸溶液的pH约为1 | |
| D. | 标准状况下,22.4L氯气与足量氢氧化钠溶液反应,转移的电子数为2NA |