题目内容
14.鲍林(L.Pauling)首先提出了电负性的概念.电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下表给出的是原子序数小于20的16种元素的电负性数值:| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
分析 (1)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低;而根据元素周期律,同周期从左向右原子半径逐渐减小;
(2)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角(零族元素除外);由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低;
(3)由表中数据可知,电负性最小的元素是第六周期,第ⅠA族.
解答 解:(1)由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,而根据元素周期律,同周期从左向右原子半径逐渐减小,所以在同周期元素中原子半径越小,元素电负性越大,故答案为:自上而下电负性降低;原子半径越小,元素电负性越大;
(2)电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角为F元素;
由表中数据可知,同周期自左而右电负性增大,同主族自上而下电负性降低,故钙元素的电负性比K元素大,但小于Mg元素的电负性,即0.8<X(Ca)<1.2,
故答案为:F;0.8;1.2;
(3)由表中数据可知,电负性最小的元素是第六周期,第ⅠA族,故答案为:六;ⅠA.
点评 本题考查电负性及与金属性非金属性的关系等,难度中等,清楚主族元素电负性的递变规律是解题关键.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
5.某有机物的结构简式为 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )
 ,下列关于该有机物的叙述不正确的是( )
,下列关于该有机物的叙述不正确的是( )| A. | 能与金属钠发生反应并放出氢气 | |
| B. | 能在催化剂作用下与H2发生加成反应 | |
| C. | 不能氧化成醛 | |
| D. | 在浓H2SO4催化下能与乙酸发生酯化反应 |
2.写出下列基团的名称:
| -C═C- | ─C≡C─ | ─CH3 | ─CH2CH3或─C2H5 |
| 双键 | 三键 | 甲基 | 乙基 |
| ─OH | -COO-R | ─CHO | ─COOH |
| 羟基 | 醛基 | 酯基 | 羧基 |
19.四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
6.质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是( )
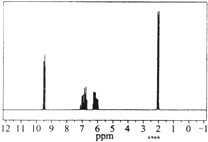

| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
5.在含有Ag+的酸性溶液中,以铁氨矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-?{Fe(SCN)}2+ (红色),K=138.下列说法中不正确的是( )
| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |

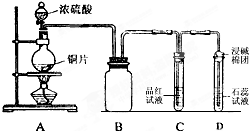 某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.
某同学为探究铜跟浓硫酸的反应情况,用如图所示装置进行了有关实验.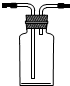 .
.