题目内容
19.四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
分析 四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,且W、X为金属,Y、Z为非金属,同周期自左而右,非金属性越强,阴离子还原性越强,电子层结构相同,核电荷数越大离子半径越小.
解答 解:四种离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构具有相同电子层结构,核外电子数相等,所以a-3=b-1=c+2=d+1,原子序数a>b>d>c.
且W、X为金属,Y、Z为非金属.
A.由于a-3=c+2,故W、Y的原子序数a>c,故A正确;
B.Y、Z同周期,原子序数c<d,故非金属性Y<Z,非金属性越强,阴离子还原性越强,故离子的还原性Y2->Z-,故B错误;
C.W形成aW3+,核外电子数为3,Y形成cY2-离子,核外电子数为6,故C错误;
D.X+、Z-离子电子层结构相同,核电荷数X>Z,核电荷数越大离子半径越小,故X+<Z-,故D错误,
故选A.
点评 本题考查结构与位置关系、元素周期律等,难度中等,根据电荷与核外电子排布相同推断元素在周期表中的位置是关键.

练习册系列答案
相关题目
9.根据元素周期表和元素周期律,下列推断正确的是( )
| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |
7.下列各组物质中,其化学键类型完全相同的是( )
| A. | NH3和H2O | B. | HCl和KCl | C. | H2O和H2O2 | D. | NaCl和NaOH |
14.鲍林(L.Pauling)首先提出了电负性的概念.电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,试回答下列问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
4.实验室制备苯甲醇和苯甲酸的化学原理如图1所示,已知苯甲醛易被空气氧化,苯甲醇的沸点为205.3℃,苯甲酸的熔点为121.7℃,沸点为249℃,溶解度为0.34g;乙醚的沸点为34.8℃,难溶于水.制备苯甲醇和苯甲酸的主要过程如图2所示,试根据上述信息,判断以下说法错误的是( )


| A. | 操作Ⅰ是萃取分液 | |
| B. | 乙醚溶液中所溶解的主要成分是苯甲醇 | |
| C. | 操作Ⅱ蒸馏所得产品甲是苯甲醇 | |
| D. | 操作Ⅲ过滤得到产品乙是苯甲酸钾 |
11.酚酞是中学阶段常用的酸碱指示剂,已知的结构简式如图所示,下列关于酚酞的说法正确的是( )


| A. | 酚酞属于芳香烃 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在碱性条件下能够发生水解反应 |
9.高锰酸钾是一种重要的化学试剂,其溶液不很稳定,在酸性条件下会分解生成二氧化锰和氧气,在中性或弱碱性溶液中分解速度很慢,见光分解速度加快.
(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项);酸性条件下高锰酸钾溶液分解的离子方程式4MnO4-+4H+═4MnO2↓+3O2↑+2H2O.
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:MnO4-+C2O42-+H+--Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
请分析高锰酸钾溶液褪色时间变化的原因反应生成的Mn2+对反应有催化作用,且c(Mn2+)浓度大催化效果更好.
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
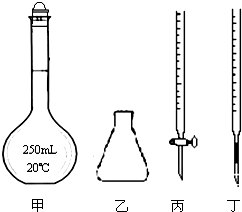
①高锰酸钾溶液应装在丙(填如图中的仪器编号).
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加.
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是A.
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.02mol/L.(附原子相对质量K=39 Mn=55 O=16 Na=23 C=12)

(1)高锰酸钾溶液应配成中性溶液并保存在棕色试剂瓶中(填保存的注意事项);酸性条件下高锰酸钾溶液分解的离子方程式4MnO4-+4H+═4MnO2↓+3O2↑+2H2O.
(2)请配平高锰酸钾溶液与草酸钠Na2C2O4溶液在酸性条件下反应的离子方程式:MnO4-+C2O42-+H+--Mn2++CO2↑+8H2O
(3)某学习小组为了探究高锰酸钾溶液和草酸钠溶液的反应过程,将高锰酸钾溶液逐滴地滴入一定体积的酸性草酸钠溶液中(温度相同,并不断振荡时),记录的现象如表:
滴入高锰酸钾溶液的次序(每滴溶液的体积相同) | 高锰酸钾溶液紫色褪去的时间 |
| 先滴入第1滴 | 1min |
| 褪色后再滴入第2滴 | 15s |
| 褪色后再滴入第3滴 | 3s |
| 褪色后再滴入第4滴 | 1s |
(4)该学习小组在获取了上述经验和结论以后,用稳定的物质草酸钠Na2C2O4(相对分子质量134.0)来标定高锰酸钾溶液的浓度.他们准确称取1.340g纯净的草酸钠配成250mL溶液,每次准确量取25.00mL溶液酸化后用KMnO4溶液滴定.
①高锰酸钾溶液应装在丙(填如图中的仪器编号).
②为了防止高锰酸钾在酸性条件下分解而造成误差,滴定时应注意的是逐滴滴入高锰酸钾溶液,待前一滴高锰酸钾溶液颜色褪去后再滴加.
③若在实验过程中存在下列操作,其中会使所测KMnO4浓度偏低的是A.
A.未润洗盛放KMnO4的滴定管
B.滴定前尖嘴部分无气泡,滴定终点时出现气泡
C.定容时,俯视刻度线
D.锥形瓶用水洗之后未用待测液润洗
④当溶液呈微红色且半分钟内不褪色,消耗KMnO4溶液20.00mL(多次测定的平均值),则KMnO4溶液的浓度为0.02mol/L.(附原子相对质量K=39 Mn=55 O=16 Na=23 C=12)
10.利用下列实验装置能 完成相应实验的是( )
| A. |  装置测定化学反应速率 | B. | 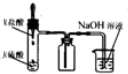 装置制取并吸收HCl | ||
| C. |  装置制备纯净NH3 | D. |  装置比较MnO2、Cl2、S |
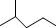 表示的分子式C6H14;名称是2-甲基戊烷.
表示的分子式C6H14;名称是2-甲基戊烷.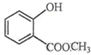 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.