题目内容
6.质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是( )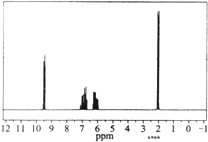
| A. | 分子中共有5种化学环境不同的氢原子 | |
| B. | 该有机物的结构简式为CH3CH=CHCOOH | |
| C. | 该物质的分子式为C4H6O | |
| D. | 该有机物不可能与氢气反应 |
分析 A.根据1H核磁共振谱中峰的种类等于氢原子的种类;
B.根据有机物质的官能团以及等效氢原子的数目比值来确定有机物质的结构简式;
C.根据有机物质的官能团以及等效氢原子的数目比值来确定有机物质的结构简式和分子式;
D.该有机物的结构简式为CH3CH=CHCOOH.
解答 解:A.1H核磁共振谱中分子共有4个峰,所以有4种化学环境不同的氢原子,故A错误;
B.峰面积之比依次为1:1:1:3,即为等效氢原子的个数比,相对分子质量为70,该有机物的结构简式为CH3CH=CHCHO,故B错误;
C.峰面积之比依次为1:1:1:3,即为等效氢原子的个数比,相对分子质量为70,该有机物的结构简式为CH3CH=CHCHO,分子式为C4H60,故C正确;
D.该有机物的结构简式为CH3CH=CHCOOH,能与氢气发生加成反应,故D错误;
故选C.
点评 本题考查有机物结构的推断、核磁共振氢谱、红外光谱、官能团的性质等,推断有机物的结构是解题的关键,难度中等.

练习册系列答案
相关题目
16.PVC管材具有耐腐蚀、重量轻、耐高压等优点,是当今世界上产量最大、应用最广的热塑性塑料之一.它是聚氯乙烯的简称,下列关于PVC说法正确的是( )
| A. | PVC的单体是CH3CH2Cl | |
| B. | PVC是高分子化合物 | |
| C. | PVC能够使溴的四氯化碳溶液褪色 | |
| D. | PVC保鲜膜最适合用来包装蔬菜、水果及熟食 |
17.下列与有机物有关的化学用语不恰当的是( )
| A. | 乙烯的比例模型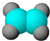 | B. | 1,3-丁二烯的键线式: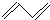 | ||
| C. | 甲基的电子式: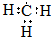 | D. | 乙醚的结构简式:CH3OCH3 |
14.鲍林(L.Pauling)首先提出了电负性的概念.电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,试回答下列问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
11.酚酞是中学阶段常用的酸碱指示剂,已知的结构简式如图所示,下列关于酚酞的说法正确的是( )
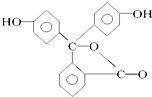

| A. | 酚酞属于芳香烃 | |
| B. | 酚酞的分子式为C20H12O4 | |
| C. | 酚酞结构中含有羟基(-OH),故酚酞属于醇 | |
| D. | 酚酞在碱性条件下能够发生水解反应 |
18.下列除去杂质的方法正确的是( )
①除去乙烷中少量的乙烯:催化条件下通入H2;②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;③除去C2H4中少量的SO2:气体通过盛氢氧化钠溶液的洗气瓶;④除去乙醇中少量的水:加足量生石灰,蒸馏.
①除去乙烷中少量的乙烯:催化条件下通入H2;②除去乙酸乙酯中少量的乙酸:用饱和碳酸氢钠溶液洗涤,分液、干燥、蒸馏;③除去C2H4中少量的SO2:气体通过盛氢氧化钠溶液的洗气瓶;④除去乙醇中少量的水:加足量生石灰,蒸馏.
| A. | ①②④ | B. | ②④ | C. | ①③④ | D. | ③④ |
16.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示,已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
17.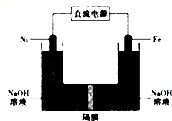 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |