题目内容
4.“摩尔盐”[(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.查阅文献得知:“摩尔盐”隔绝空气加热至500℃时可完全分解,但产物复杂.某学习小组欲探究其分解产物.Ⅰ.提出猜想摩尔盐受热分解,小组同学认为分解产物可能有以下几种情况:
a.Fe2O3、SO3、NH3、H2O
b.FeO、NH3、SO3、H2O
c.FeO、SO2、NH3、H2O
d.Fe2O3、NH3、SO2、SO3、H2O
经认真分析,通过推理即可确定,猜想ac不成立(填序号).
Ⅱ.实验探究为检验分解产物,甲同学设计了如下实验装置.
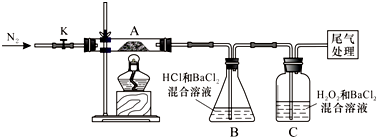
请回答下列问题:
(1)B装置的容器名称是锥形瓶.
(2)取一定量“摩尔盐”置于加热管A中,加热至分解完后打开K,再通入N2,目的是使分解产生的气体在B、C中被吸收充分.
(3)观察到A中固体逐渐变为红棕色,B、C中均产生白色沉淀.C中发生反应的离子方程式为SO2+H2O2+Ba2+=BaSO4↓+2H+.
(4)待A中剩余固体冷却至室温后,取少量置于试管中,加入稀硫酸溶解,再滴几滴KSCN溶液,可以观察到的现象是溶液变红色.
(5)乙同学设计实验验证A中残留物不含FeO,操作方法及实验现象是:取少量A中残留物放入试管中,加稀硫酸溶解,再滴加K3[Fe(CN)6]溶液,不产生蓝色沉淀,说明没有Fe2+.
Ⅲ.实验反思
乙同学认为:装置B中产生白色沉淀不能证明分解产物中一定含SO3,原因是分解产生的氨气消耗完B装置中的HCl后,过量的氨气存在时二氧化硫与BaCl2溶液反应生成白色沉淀.
分析 I.摩尔盐中N为-3价,Fe为+2价,S为+6价,根据产物中化合价分析;
II.(1)根据装置图分析;
(2)A中固体充分加热较长时间后,通入氮气目的是使分解生成的气体在BC装置中完全吸收;
(3)C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4;
(4)由(3)中描述可知,A中固体逐渐变为红棕色说明用氧化铁生成,用硫酸溶解,溶液中有Fe3+;
(5)把固体用非氧化性酸溶解,再用K3[Fe(CN)6]溶液检验;
III.氨气过量时,二氧化硫与氨气生成亚硫酸铵,再与BaCl2溶液反应.
解答 解:I.摩尔盐中N为-3价,Fe为+2价,S为+6价,
a.Fe2O3、SO3、NH3、H2O 反应时只有Fe元素的化合价升高,不符合氧化还原反应规律,故a错误;
b.FeO、NH3、SO3、H2O,反应时没有元素化合价的变化,只是发生分解反应,故b正确;
c.FeO、SO2、NH3、H2O反应时只有S元素的化合价降低,不符合氧化还原反应规律,故c错误;
d.Fe2O3、NH3、SO2、SO3、H2O反应时,Fe的化合价升高,S的化合价降低,符合氧化还原反应规律,故d正确.
故答案为:ac;
II.(1)由装置图可知,B装置是锥形瓶;故答案为:锥形瓶;
(2)A中固体充分加热较长时间后,产生气体有一部分残留在装置中,通入氮气可以使分解生成的气体在B、C装置中完全吸收;
故答案为:使分解产生的气体在B、C中被吸收充分;
(3)C中有白色沉淀生成,是因为SO2被双氧水氧化成SO42-,SO42-再与Ba2+结合成沉淀BaSO4则C中发生的反应为SO2+H2O2+Ba2+=BaSO4↓+2H+;
故答案为:SO2+H2O2+Ba2+=BaSO4↓+2H+;
(4)由(3)中描述可知,A中固体逐渐变为红棕色说明用氧化铁生成,用硫酸溶解,溶液中有Fe3+,在溶液中滴几滴KSCN溶液,则溶液会变红色;
故答案为:溶液变红色;
(5)要验证A中残留物不含FeO,先取少量A中残留物放入试管中,再加入稀硫酸或盐酸溶解,然后滴加K3[Fe(CN)6]溶液检验,若不产生蓝色沉淀,说明没有Fe2+;
故答案为:加稀硫酸溶解,再滴加K3[Fe(CN)6]溶液,不产生蓝色沉淀,说明没有Fe2+;
III.氨气过量时,产生的氨气消耗完B装置中的HCl后二氧化硫与氨气生成亚硫酸铵,亚硫酸铵与BaCl2溶液反应生成BaSO3沉淀,所以不能说明分解产物中一定含SO3,故答案为:分解产生的氨气消耗完B装置中的HCl后,过量的氨气存在时二氧化硫与BaCl2溶液反应生成白色沉淀.
点评 本题考查了物质性质的实验探究和实验设计,题目涉及氧化还原反应、离子方程式的书写、离子检验、实验基本操作等,侧重于考查学生对基础知识的综合应用能力,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 治理“地沟油”,可通过水解反应制得肥皂 | |
| B. | 硅晶体具有半导体性能,可用于制取光导纤维 | |
| C. | 人类超量碳排放及氮氧化物和二氧化硫的排放是形成酸雨的主要原因 | |
| D. | PM2.5是指空气中直径≤2.5 μm的颗粒物,直径为2.5 μm的颗粒物分散在空气中形成胶体 |
| A. | 对二甲苯 | B. | 乙烷 | C. | 乙醇 | D. | 萘(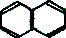 ) ) |
 一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )
一种光化学电池的结构如图,当光照在表面涂有氯化银的银片上时,AgCl(s)=AgCl(s)=Ag (s)+Cl(AgCl),[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着Cl(AgCl)+e-→Cl-(aq),若将光源移除,电池会立即回复至初始状态.下列说法正确的是( )| A. | 光照时,电流由Y流向X | |
| B. | 光照时,Pt电极发生的反应为2Cl-+2e-=Cl2 | |
| C. | 光照时,Cl-向Ag电极移动 | |
| D. | 光照时,电池总反应为:AgCl(s)+Cu+(aq)$\frac{\underline{\;光\;}}{\;}$Ag (s)+Cu2+(aq)+Cl-(aq) |
| A. | NO2、Cl2O7都是酸性氧化物 | B. | 水银、水玻璃都是混合物 | ||
| C. | HD、HCHO都是极性分子 | D. | 干冰、可燃冰都是分子晶体 |
| A. | HF、HCl、HBr、HI的酸性逐渐增强,说明F、Cl、Br、I的非金属性逐渐增强 | |
| B. | 元素R最高正价为+7价,表明R元素一定是ⅦA族元素 | |
| C. | 从元素在周期表中的位置可以推断,硅和锗都可用作半导体材料 | |
| D. | 若M+和R2-具有相同的电子层结构,则原子半径:M<R |
| A. | PVC的单体是CH3CH2Cl | |
| B. | PVC是高分子化合物 | |
| C. | PVC能够使溴的四氯化碳溶液褪色 | |
| D. | PVC保鲜膜最适合用来包装蔬菜、水果及熟食 |
| A. | 常温常压下,22.4 L乙烯中含C-H键的数目为4NA | |
| B. | 0.1 mol•L-1的(NH4)2SO4溶液中含有阳离子的总数为0.2NA | |
| C. | 7.8 g Na2S固体和7.8 g Na2O2固体中含有的阴离子数目均为0.1NA | |
| D. | 标准状况下,2.24 L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)