题目内容
5.在含有Ag+的酸性溶液中,以铁氨矾NH4Fe(SO4)2作指示剂,用KSCN的标准溶液滴定Ag+.已知:AgSCN(白色s)?Ag++SCN-,Ksp=1.0×10-12;Fe3++SCN-?{Fe(SCN)}2+ (红色),K=138.下列说法中不正确的是( )| A. | 边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀 | |
| B. | 当溶液出现红色且半分钟不褪色时即为确定终点 | |
| C. | 上述实验可用KCl标准溶液代替KSCN的标准溶液滴定Ag+ | |
| D. | 滴定时,必须控制溶液的pH,防止Fe3+水解,影响终点的观察. |
分析 A.从溶度积常数来判断沉淀的生成;
B.由常数可知,先生成AgSCN沉淀,然后生成{Fe(SCN)}2+,根据颜色变化判断;
C.氯化钾和铁离子不反应;
D.铁离子易水解生成红褐色氢氧化铁胶体,干扰实验现象的观察.
解答 解:A.AgSCN的溶度积常数很小,边滴定,边摇动溶液,溶液中首先析出AgSCN白色沉淀,故A正确;
B.Fe3++SCN-?FeSCN2+(红色),K=138,比较大,故正向反应容易进行,故当Ag+定量沉淀后,少许过量的SCN-与Fe3+生成红色配合物,且半分钟不褪色时即为终点,故B正确;
C.硫氰化钾和铁离子形成红色溶液,氯化钾和铁离子不反应,故不能用KCl标准溶液代替KSCN的标准溶液滴定Ag+,故C错误;
D.铁离子易水解生成红褐色氢氧化铁胶体,干扰实验现象的观察,因此,滴定时要控制溶液一定的酸性,故D正确;
故选C.
点评 本题考查化学实验方案的评价,侧重于滴定操作的考查,有利于培养学生良好的科学素养,注意化学实验操作的考查,熟悉高考中对化学实验注意事项及操作要点的考查,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.鲍林(L.Pauling)首先提出了电负性的概念.电负性也是元素的一种重要性质,电负性越大,其原子吸引电子的能力越强,在所形成的分子中成为带负电荷的一方.下表给出的是原子序数小于20的16种元素的电负性数值:
请仔细分析,试回答下列问题:
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
(1)根据表中所给数据分析推测:
同主族的不同元素的电负性变化的规律是:自上而下电负性降低
同周期中,电负性与原子半径的关系为:原子半径越小,元素电负性越大.
(2)预测周期表中电负性最大的元素应为F(填元素符号);估计钙元素的电负性的取值范围:0.8<Ca<1.2
(3)预测周期表中,电负性最小的元素位于第六周期ⅠA族(放射性元素除外)
16.短周期主族元素X、Y、Z、W在元素周期表中的相对位置如下图所示,已知X的最低负价与Y的最高正价代数和为零,下列说法正确的是( )
| X | ||||
| Y | Z | W |
| A. | X分别与Y、Z形成的化合物中化学键类型相同 | |
| B. | Z的最高价氧化物的对应水化物酸性比W的强 | |
| C. | X的简单气态氢化物的稳定性比W的强 | |
| D. | 原子半径的大小顺序:r(Y)>r(Z)>r(W)>r(X) |
13.25℃时,下列叙述正确的是( )
| A. | NH4HSO4溶液中滴加NaOH溶液至pH=7,则c(Na+)=2c(SO42-) | |
| B. | 0.1 mol•L-1CH3COOH溶液与0.1 mol•L-1CH3COONa等体积混合pH<7,则c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) | |
| C. | AgCl在水中溶解度与在稀盐酸中溶解度相同 | |
| D. | KNO3溶液和CH3COONH4溶液pH均为7,则两溶液中水的电离程度相同 |
20.CO在空气中体积分数为0.13~0.74之间时,会发生猛烈的爆炸.当CO与空气中的O2恰好完全反应时,爆炸最猛烈.现有CO与空气的混合气体发生爆炸后,则生成的C02的体积分数可能为(设空气中N2的体积分数为0.79,O2为0.21)( )
| A. | 0.10 | B. | 0.20 | C. | 0.30 | D. | 0.40 |
10.利用下列实验装置能 完成相应实验的是( )
| A. |  装置测定化学反应速率 | B. | 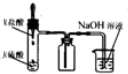 装置制取并吸收HCl | ||
| C. |  装置制备纯净NH3 | D. |  装置比较MnO2、Cl2、S |
17.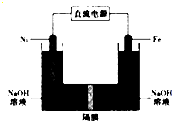 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
 高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )
高铁酸盐在能源、环保领域有广泛用途.我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐(Na2FeO4)的方案,装置如图所示.下列说法正确的是( )| A. | 电子的流动方向是从铁电极流出通过溶液到镍电极 | |
| B. | 铁作阳极,电极反应式为Fe+80H--6e-═FeO42-+4H20 | |
| C. | 镍作阳极,电极反应式为40H--4e-═O2+2H20 | |
| D. | 镍作阴极发生氧化反应在镍电极附近有H2生成 |
14.已知A,B、C,D、E是短期中原子序数依次增大的5种主族元素,其中元素A.E的单质在常温下呈气态.元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料.下列说法正确的是( )
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 一定条件下,元素C,D的最高氧化物对应的水化物之问能发生反应 | |
| C. | 工业上常用电解法制备元素A、C、D的单质 | |
| D. | 化合物AE与CE含有相同类型的化学键 |
15.单位体积的稀溶液中,非挥发性溶质的分子或离子数越多,该溶液的沸点越高.下列溶液中沸点最高的是( )
| A. | 0.01 mol/L的蔗糖溶液 | B. | 0.02 mol/L的CH3COOH溶液 | ||
| C. | 0.02 mol/L的NaCl溶液 | D. | 0.01 mol/L的K2SO4溶液 |