题目内容
18.下列说法正确的是( )| A. | 将废电池深埋,可防止重金属污染 | |
| B. | 所有自发进行的化学反应都是放热反应 | |
| C. | 开发太阳能、风能和氢能等能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 开发利用可燃冰是缓解能源紧缺的唯一途径 |
分析 A.电池中的重金属离子污染土壤和水源;
B.反应自发进行的判断依据为△G=△H-T•△S;
C.太阳能、风能和氢能是洁净能源;
D.可燃冰(固态甲烷水合物)可作燃料.
解答 解:A.为防止电池中的重金属离子污染土壤和水源,废电池要集中处理,不能深埋,故A错误;
B.反应能否自发取决于焓变和熵变的复合判据,对于吸热反应,在一定温度下也能进行,故B错误;
C.开发太阳能、风能和氢能等洁净能源可减少化石燃料的使用,减少污染物的排放,故C正确;
D.可燃冰(固态甲烷水合物)可作燃料,合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺,但这不是缓解能源紧缺的唯一途径,开发氢能、地热能、风能等都有助于缓解能源紧缺,故D错误.
故选C.
点评 本题考查了化学知识在生活实际的应用,熟悉能源问题、废旧电池回收等即可解答,题目较简单.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.用NA表示阿伏加德罗常数的数值,下列叙述正确的是( )
| A. | 在标况下,22.4L SO3和22.4L C2H4原子个数比为2:3 | |
| B. | 将78g Na2O2与过量CO2反应,CO2转移的电子数为2NA | |
| C. | 含0.2mol H2SO4的浓硫酸与足量铜充分反应,生成SO2分子的数目少于0.1NA | |
| D. | 电解精炼铜时,若阳极质量减少32g,则阴极转移的电子的数目为NA |
9.碳酸钠一种重要的化工原料.工业碳酸钠纯度约为 98%,其中含有 Ca2+、Mg2+、Fe3+、Cl-和 SO42-等杂质,提纯工艺线路如图:
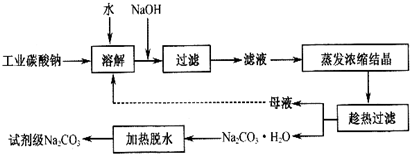
有关物质的溶度积如表:
请回答下列问题:
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.

有关物质的溶度积如表:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.
6.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
13.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
3.下列叙述正确的是( )
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
8.Na2O2晶体中含有的化学键有( )
| A. | 离子键、σ键 | B. | 极性键、离子键 | C. | 离子键 | D. | 离子键、π键 |
 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
