题目内容
14.氯吡格雷(clopidogrel-1)是一种用于抑制血小板聚集的药物,可通过如图方法合成:
已知:①
 ,②
,② 中氯原子较难水解.
中氯原子较难水解.(1)A→B的转化中存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
 或
或 .
.(2)E→F的反应类型是取代或酯化反应
(3)X的结构简式为
 .
.(4)B→C反应的化学方程式
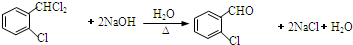 .
.(5)两分子E可在一定条件下反应,生成的有机产物分子中含有3个六元环,写出该反应的化学方程式
 .
.(6)物质F的某种同分异构体满足以下条件:
①结构中存在氨基;
②苯环上有两种不同化学环境的氢;
③能发生银镜反应,其碱性条件下水解的两种产物也能发生银镜反应;
写出符合条件的一种同分异构体结构简式
 .
.(7)已知:③
 ,写出由乙烯、甲醇为有机原料制备化合物
,写出由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH→浓H2SO4170℃CH2=CH2Br2→
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH→浓H2SO4170℃CH2=CH2Br2→
分析 E和甲醇发生酯化反应生成F,F取代反应生成G,根据F、G结构简式结合X分子式知,X结构简式为 ,G发生取代反应生成氯砒格雷,
,G发生取代反应生成氯砒格雷,
(1)A→B是甲基在光照条件下的取代反应,其是连续取代的过程,可能是1取代、2取代或3取代;
(2)E和甲醇发生酯化反应生成F;
(3)根据F、G结构简式结合X分子式知,X结构简式为 ;
;
(4)B→C是卤代烃的水解,结合题给信息解答;
(5)两分子E可在一定条件下反应,生成的有机产物分子中含有3个六元环,是2分子E生成二肽的反应;
(6)据F的结构简式和题给条件书写其同分异构体;
(7)乙醇发生消去反应生成乙烯,乙烯与溴发生加成反应生成1,2-二溴乙烷,再发生水解反应生成乙二醇,甲醇催化氧化生成HCHO,最后乙二醇与甲醛反应生成 .
.
解答 解:(1)邻氯甲苯在光照条件下与氯气反应的产物有除A外还有 和
和 ,故答案为:
,故答案为: 或
或 ;
;
(2)E和甲醇发生酯化反应生成F,故答案为:取代或酯化;
(3)根据F、G结构简式结合X分子式知,X结构简式为 ,故答案为:
,故答案为: ;
;
(4)卤代烃在NaOH溶液中水解,生成2个羟基,脱水生成醛基,化学方程式为 ,
,
故答案为: ;
;
(5)2分子E生成二肽的反应的化学方程式为 ,
,
故答案为: ;
;
(6)①结构中存在氨基;
②苯环上有两种不同化学环境的氢,说明氨基和甲酯基在对位;
③能发生银镜反应,其碱性条件下水解的两种产物也能发生银镜反应,说明含有甲酯基;
其结构简式为 ,故答案为:
,故答案为: ;
;
(7)由乙烯、甲醇为有机原料制备化合物 ,首先乙烯与卤素加成生成1,2-二溴乙烷,其在NaOH的水溶液中水解生成乙二醇,甲醇氧化生成甲醛,甲醛与乙二醇反应生成
,首先乙烯与卤素加成生成1,2-二溴乙烷,其在NaOH的水溶液中水解生成乙二醇,甲醇氧化生成甲醛,甲醛与乙二醇反应生成 ,合成路线为
,合成路线为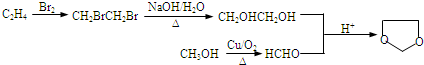 ,
,
故答案为: .
.
点评 本题考查有机物合成,侧重考查学生分析推断及知识迁移能力,为高考高频点,能根据流程图中结构简式变化方式判断反应类型,难点是合成路线的设计,根据反应物及目标产物结合有机物中官能团及其性质设计合成路线即可,题目难度中等.

 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案| A. | CH3-CH=CH-CHO | B. | CH3-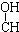 - -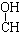 -CH3 -CH3 | ||
| C. | HOCH2-CH2-CH=CH-CHO | D. | HOCH2-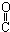 -CH2-CHO -CH2-CHO |
| A. | 水 | B. | 新制氢氧化铜浊液 | ||
| C. | 碳酸钠溶液 | D. | 紫色石蕊试液 |
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
有关物质的溶度积如表:
| 物质 | CaCO3 | MgCO3 | Ca(OH)2 | Mg(OH)2 | Fe(OH)3 |
| Ksp | 4.96×10-9 | 6.82×10-6 | 4.68×10-6 | 5.61×10-12 | 2.64×10-39 |
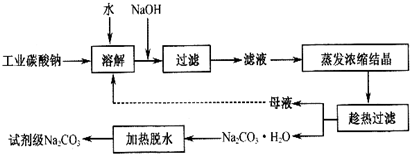
(1)碳酸钠是制造普通玻璃的主要原料,请写出制造普通玻璃过程中发生的化学反应方程式SiO2+Na2CO3高温_Na2SiO3+CO2↑.
(2)上述提纯过程中加入NaOH溶液时,反应的离子方程式为Fe3++3OH-=Fe(OH)3↓,MgCO3+2OH-=Mg(OH )2+CO32-;当溶液的pH=8时,溶液中c(Mg 2+):c(Fe3+)=2.125×1021.
(3)“母液”中除了含有 Na+、CO32-离子外,还含有Cl-、SO42-等离子.
(4)有人从“绿色化学”角度设想将“母液”直接进行循环使用.请你分析实际工业生产中是否可行不可行(填“可行”或“不可行”)并说明理由若“母液”循环使用,则溶液中 c(Cl-)和c(SO42-)增大,最后所得产物
Na2 CO3混有杂质.
(5)试剂级碳酸钠的检验标准为:纯度≥99.5%,为了检验提纯后的碳酸钠是否达标,实验室称取1.06g样品,溶于水配制成100mL溶液,量取20.00mL,滴入2滴甲基橙作为指示剂,用0.1000mol/L的标准盐酸进行滴定,三次滴定后使用盐酸的平均体积为39.84mL,请计算,该样品碳酸钠的纯度为99.6%.
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,c(NH+4)c(NH3•H2O)比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
