题目内容
11.以下叙述错误的是( )| A. | 氢气与氯气反应后,体系的能量降低 | |
| B. | 需要加热才能发生的反应一定是吸热反应 | |
| C. | 若生成物的总能量高于反应物的总能量,则反应过程吸收能量 | |
| D. | 化学反应的实质是旧化学键的断裂和新化学键的形成 |
分析 A、根据氢气与氯气反应为放热反应,反应前体系能量大于反应后体系能量判断;
B、铝热反应需高温条件下发生,却属于放热反应;
C、在一个确定的化学反应关系中,反应物的总能量既可以高于生成物的总能量又可以低于生成物的总能量;
D、根据化学反应的实质分析判断.
解答 解:A、因为氢气与氯气反应为放热反应,反应前体系能量大于反应后体系能量,所以体系的能量降低,故A正确;
B、需要加热才能发生的反应可能是放热反应,也可能为吸热反应,例如铝热反应需高温条件下发生,却属于放热反应,故B错误;
C、反应物的总能量既可以高于生成物的总能量又可以低于生成物的总能量,若生成物的总能量高于反应物的总能量,则反应过程吸收能量,故C正确;
D、化学反应的实质就是旧化学键的断裂和新化学键的形成,故D正确.
故选B.
点评 本题是对化学变化与能量的考查,解决的关键是明确化学变化的实质与化学键的关系,属基础性知识考查题.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
1.下列说法中正确的是( )
| A. | Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 小苏打是制作面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| C. | S、C、Si都是自然界中含量丰富的非金属元素,三种元素的二氧化物都属于酸性氧化物,均能与碱反应而不能与酸反应 | |
| D. | 碱性氧化物都是由金属元素和氧元素组成,如K2O、CuO、Na2O、Na2O2、Mn2O7、Fe2O3等全部由金属元素和氧元素组成的,因此都为碱性氧化物 |
2.关于各组溶液中微粒浓度的关系正确的是( )
| A. | 将一定量氨气通入0.1 mol/L NH4Cl溶液中可能有:c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 等物质的量的NaClO和NaHCO3的混合溶液中一定有:c(HClO)+c(ClO-)=c( HCO3-)+c( H2CO3)+c(CO32-) | |
| C. | 向CH3COONa溶液中滴加稀盐酸至溶液呈中性时有:c(Cl-)>c( Na+)>c( CH3COOH) | |
| D. | 等浓度等体积的CH3COOH溶液和CH3COONa溶液混合均匀后:c(CH3COO-)+c(CH3COOH)=c(Na+) |
19.工业生产硫酸过程中的一步反应是2SO2(g)+O2(g)?2SO3(g).如果该反应在密闭容器内进行,能说明该反应达到化学平衡状态的是( )
| A. | SO2完全转化为SO3 | |
| B. | 消耗2 mol SO2的同时生成2 mol SO3 | |
| C. | SO2、O2与SO3的物质的量之比为2:1:2 | |
| D. | SO2、O2与SO3的浓度不再随时间变化 |
6.有A、B、C、D四块金属片,进行如下实验,①A、B用导线相连后,同时插入稀H2SO4中,A极为负极 ②C、D用导线相连后,同时浸入稀H2SO4中,电子由C→导线→D ③A、C相连后,同时浸入稀H2SO4,C极产生大量气泡 ④B、D相连后,同时浸入稀H2SO4中,D极发生氧化反应,则四种金属的活动性顺序为( )
| A. | A>B>C>D | B. | B>D>C>A | C. | C>A>B>D | D. | A>C>D>B |
16.下列说法中正确的有的是( )
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成汽油 | |
| D. | 催化剂是决定化学反应速率的主要因素 |
3.下列叙述正确的是( )
| A. | 铅蓄电池放电过程中,正极质量增加,负极质量减小 | |
| B. | 将0.1 mol•L-1的NH3•H2O溶液加水稀释,$\frac{c(N{H}_{4}^{+})}{c(N{H}_{3}•{H}_{2}O)}$比值减小 | |
| C. | NaHCO3溶于水,溶液中存在电离平衡 | |
| D. | CaCO3(s)═CaO(s)+CO2(g),△H>0,该反应在任意温度下都能自发进行 |
20.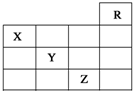 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是深红棕色液体,具有氧化性
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
 如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )
如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是( )①X的气态氢化物与Y最高价氧化物对应的水化物的溶液能发生反应生成盐
②同浓度的Y、Z的气态氢化物的水溶液的酸性Y<Z
③Z的单质常温下是深红棕色液体,具有氧化性
④Z的原子序数比Y大19
⑤Z所在的周期中含有32种元素.
| A. | 只有③ | B. | 只有①④ | C. | 只有①②③④ | D. | ①②③④⑤ |
1.结晶牛胰岛素是中国科学家于1965年在世界上第一个人工合成的,其具有生物活性,那么结晶牛胰岛素本质上是什么( )
| A. | 糖类 | B. | 脂肪 | C. | 维生素 | D. | 蛋白质 |