题目内容
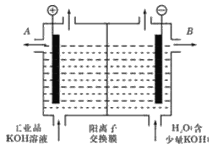
【题目】某化学研究性小组采用如下装置(夹持和加热仪器已略去)电解饱和食盐水一段时间,并通过实验测定产物的量来判断饱和食盐水的电离率。饱和食盐水的电解率=(电解的氯化钠质量/总的氯化钠质量)×100%
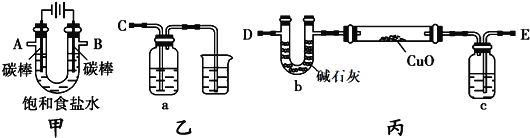
甲方案:利用甲、乙装置测定饱和食盐水的电解率
(1)若饱和食盐水中滴有酚酞,则电解过程中甲装置中的U形管左端的实验现象为_____; 该电解池总反应的化学方程式为_______;
(2)若洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,则正确的连接顺序为________连______(填A、B、C、D、E等导管口),则洗气瓶a中发生反应的离子方程式为_______;
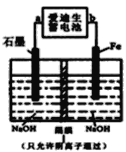
乙方案:利用甲、丙装置测定饱和食盐水的电解率
(3)对于乙方案,有同学提出有两种方法都可测得饱和食盐水的电解率
Ⅰ.通过测定硬质玻璃管中氧化铜固体前后质量差来计算饱和食盐水的电解率。
Ⅱ.通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率
①一同学认为可以在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,则 该干燥装置应与______口连接(填A、B、C、D、E等导管口)。
②另一同学认为乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,你是否同意?_____(填“同意”或“不同意”)请说明理由 ____。
丙方案:只利用甲装置测定饱和食盐水的电解率
(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,求饱和食盐水的电解率_______(保留一位小数,假设电解前后溶液体积不变,饱和食盐水密度约为1.33g/mL,溶解度为36.0g)。
【答案】(1)碳棒上有气泡产生,溶液变红2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑(2)B连C Cl2+2OH—=H2O+Cl—+ ClO—(3)D 同意 在乙方案中氢气还原氧化铜,氢气不能全部反应,误差太大。 (4)16.6%
2NaOH+H2↑+Cl2↑(2)B连C Cl2+2OH—=H2O+Cl—+ ClO—(3)D 同意 在乙方案中氢气还原氧化铜,氢气不能全部反应,误差太大。 (4)16.6%
【解析】
试题(1)甲装置图分析电解饱和食盐水,溶液中氯离子在阳极上失电子生成氯气,氢离子在阴极得到电子生成氢气,阴极附近氢氧根离子浓度增大,遇到酚酞溶液变红色,电解过程中甲装置中的实验现象为:左右碳棒上都有气泡产生,左边碳棒附近溶液变红,总电解反应方程式为2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(2)洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,氢氧化钠溶液可以吸收氯气发生反应的离子方程式为Cl2+2OH-=H2O+Cl-+ClO-,电解池中B端为阳极生成氯气,装置B连C;(3)①利用甲、丙装置测定饱和食盐水的电解率,方法Ⅱ通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,应连接装置D处;②乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,主要是氢气还原氧化铜过程中不能全部发生反应,造成误差;(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,c(H+)=10-14mol/L,c(OH-)=1mol/L,氢氧根离子物质的量=0.15L×1mol/L=0.15mol,2NaCl+2H2O
2NaOH+H2↑+Cl2↑;(2)洗气瓶a中盛放的为足量的氢氧化钠溶液,通过测定洗气瓶a在电解前后的质量变化来计算饱和食盐水的电解率,氢氧化钠溶液可以吸收氯气发生反应的离子方程式为Cl2+2OH-=H2O+Cl-+ClO-,电解池中B端为阳极生成氯气,装置B连C;(3)①利用甲、丙装置测定饱和食盐水的电解率,方法Ⅱ通过测定丙装置中除硬质玻璃管外的某装置前后质量差来计算饱和食盐水的电解率,是利用U形管测定氢气还原氧化铜过程中生成的水蒸气,在乙方案方法Ⅱ中的装置中添加一干燥装置防止外界空气中的水蒸气的干扰,应连接装置D处;②乙方案的方法Ⅰ、Ⅱ测得的实验结论都不正确,主要是氢气还原氧化铜过程中不能全部发生反应,造成误差;(4)若电解150mL饱和食盐水一段时间,测得溶液的为pH为14,c(H+)=10-14mol/L,c(OH-)=1mol/L,氢氧根离子物质的量=0.15L×1mol/L=0.15mol,2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,电解的氯化钠物质的量为0.15mol,质量=0.15mol×58.5g/mol=8.775g,饱和食盐水密度约为1.33g/mL,150mL饱和食盐水质量=1.33g/mL×150ml=199.5g,依据溶解度计算溶液中含有溶质氯化钠质量=199.5g×(36g/(100g+36g)=52.81g,电解率=8.775g/52.81g×100%=16.6%。
2NaOH+H2↑+Cl2↑,电解的氯化钠物质的量为0.15mol,质量=0.15mol×58.5g/mol=8.775g,饱和食盐水密度约为1.33g/mL,150mL饱和食盐水质量=1.33g/mL×150ml=199.5g,依据溶解度计算溶液中含有溶质氯化钠质量=199.5g×(36g/(100g+36g)=52.81g,电解率=8.775g/52.81g×100%=16.6%。

【题目】某学习小组同学根据影响化学反应速率的因素进行实验验证,其设计的实验方案如下:请你帮他们把表填写完整,并做出评价。
(1)甲同学验证还原性:I->Br-
实验步骤 | 实验现象 | 实验结论及离子反应式 |
| 逐滴加入的同时振荡,观察CCl4层的颜色: 甲___ 乙___; 乙中CCl4层颜色明显变化的快。 | 离子方程式: 甲__ 乙__ 结论:验证成立,还原性,I->Br- |
(评价)甲同学设计的实验方案是__(填“合理”或“不合理”),理由是__。
(3)乙同学验证固体反应物的颗粒大小的对反应速率影响
实验步骤:在试管①中加入1g粉末状大理石,加入4mol/L盐酸20mL(过量);在试管②中加入2g颗粒状大理石,加入4mol/L盐酸20mL(过量)。他根据实验过程,绘制出的生成CO2生成体积(折算成标准状况)V(CO2)同反应时间t的关系曲线图,你认为__是符合的。

【题目】自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展。
(1)下表列举了不同温度下大气固氮的部分平衡常数K值。
反应 | 大气固氮N2(g)+O2(g) | |
温度/℃ | 27 | 2260 |
K | 3.84×10-31 | 1 |
①分析数据可知:大气固氮反应属于______(填“吸热”或“放热”)反应。
②2260℃时,向2 L密闭容器中充入0.3mol N2和0.3mol O2,20 s时反应达平衡。则此 时得到NO____mol,用N2表示的平均反应速率为____。
(2)已知工业固氮反应:N2(g)+3H2(g) ![]() 2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
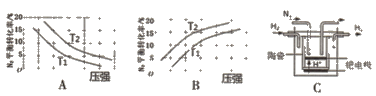
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它 内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨。其示意图如C所示,阴极的电极反应式为______。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3 (aq) +3O2(g) △H。
4NH3 (aq) +3O2(g) △H。
已知:①N2(g)+3H2(g) ![]() 2NH3(g) △H1
2NH3(g) △H1
②2H2(g) +O2(g) ![]() 2H2O(1) △H2
2H2O(1) △H2
③NH3(g) ![]() NH3(aq) △H3
NH3(aq) △H3
则△H= ________(用含△H1、△H2、△H3的式子表示)。