题目内容
【题目】ⅥA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含ⅥA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:
(1)已知H2O2的结构如图:

H2O2分子不是直线形的,两个H原子犹如在半展开的书的两面纸上,书页角为93°52′,而两个O—H键与O—O键的夹角均为96°52′。根据该结构写出H2O2分子的电子式______。估计它难溶于CS2,简要说明原因:________________。
(2)O、S、Se原子的第一电离能由大到小的顺序为____________________。
(3)H2Se的酸性比H2S_____(填“强”或“弱”)。气态SeO3分子的立体构型为______,SeO32-离子中Se的杂化方式为______。
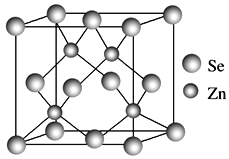
(4)硒化锌的晶胞结构如图所示,硒离子的配位数是____,若晶胞参数为d pm,则硒化锌的密度为______ g·cm-3。(不需要化简,1 m=109 nm=1012 pm)。
【答案】![]() 因H2O2为极性分子,而CS2为非极性溶剂,根据相似相溶规律,H2O2难溶于CS2中 O>S>Se 强 平面三角形 sp3 4
因H2O2为极性分子,而CS2为非极性溶剂,根据相似相溶规律,H2O2难溶于CS2中 O>S>Se 强 平面三角形 sp3 4 ![]()
【解析】
(1)过氧化氢是共价化合物,过氧根中氧原子形成一个共价键,其余氢原子分别形成一个共价键,根据电子式的书写方法来写电子式;判断H2O2、CS2分子的极性,依据相似相溶的原理解答;
(2)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱;
(3)同主族氢化物水溶液的酸性依次增强,同周期氢化物稳定性增强;根据价层电子对互斥理论确定分子空间构型及原子杂化方式;
(4)每个Se原子连接4个Zn原子;晶胞体积V=(d×10-10 cm)3,该晶胞中Zn原子个数是4、Se原子个数=8×![]() +6×
+6×![]() =4,晶胞密度=
=4,晶胞密度=![]() 。
。
(1)双氧水是一种含有氧氧共价键和氧氢共价键的极性分子,电子式为:![]() ,相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2;
,相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,H2O2是极性分子,CS2是非极性分子,依据相似相溶的原理可知,H2O2难溶于CS2;
(2)同主族元素从上到下,原子半径越来越大,原子核对核外电子的吸引力越来越弱,第一电离能逐渐减小,故答案为O>S>Se;
(3)H2Se的酸性比H2S强,SeO3中心原子Se电子对数=3+![]() =3,中心原子是sp2杂化,不存在孤电子对,空间构型为平面三角形,SeO32-离子的价层电子对数=3+
=3,中心原子是sp2杂化,不存在孤电子对,空间构型为平面三角形,SeO32-离子的价层电子对数=3+![]() (6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;
(4)每个Se原子连接4个Zn原子,所以Se的配位数是4;晶胞体积V=(d×10-10 cm)3,该晶胞中Zn原子个数是4、Sn原子个数=8×![]() +6×
+6×![]() =4,晶胞密度=
=4,晶胞密度=![]() =
=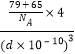 g/cm3=
g/cm3=![]() g/cm3。
g/cm3。