题目内容
【题目】自从1902年德国化学家哈伯研究出合成氨的方法以来,氮的固定的相关研究获得了不断的发展。
(1)下表列举了不同温度下大气固氮的部分平衡常数K值。
反应 | 大气固氮N2(g)+O2(g) | |
温度/℃ | 27 | 2260 |
K | 3.84×10-31 | 1 |
①分析数据可知:大气固氮反应属于______(填“吸热”或“放热”)反应。
②2260℃时,向2 L密闭容器中充入0.3mol N2和0.3mol O2,20 s时反应达平衡。则此 时得到NO____mol,用N2表示的平均反应速率为____。
(2)已知工业固氮反应:N2(g)+3H2(g) ![]() 2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
2NH3 (g) △H<0,在其他条件相同时,分别测定此反应中N2的平衡转化率随压强和温度(T)变化的曲线如下图A、B所示,其中 正确的是_____(填“A”或“B”),T1______T2(填“>”或“<”)。
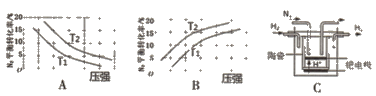
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它 内外表面上的金属钯多晶薄膜做电极,通过电解实现高温常压下的电化学合成氨。其示意图如C所示,阴极的电极反应式为______。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3 (aq) +3O2(g) △H。
4NH3 (aq) +3O2(g) △H。
已知:①N2(g)+3H2(g) ![]() 2NH3(g) △H1
2NH3(g) △H1
②2H2(g) +O2(g) ![]() 2H2O(1) △H2
2H2O(1) △H2
③NH3(g) ![]() NH3(aq) △H3
NH3(aq) △H3
则△H= ________(用含△H1、△H2、△H3的式子表示)。
【答案】(1)①吸热 (1分)②0.2 (2分)0.0025 mol·L-1·s-1(2分)
(2)B ;> (每空2分) ;
(3)N2+6H++6e-=2NH3(3分)(4)2△H1-3△H2+4△H3(3分)
【解析】
试题(1)①大气固氮反应的化学平衡常数:升高温度,化学平衡常数增大,说明升高温度,化学平衡正向移动,正反应反应是吸热反应,即大气固氮反应属于吸热反应;②在反应开始时,c( N2)=c(O2)= 0.3mol÷2L=0.15mol/L,假设平衡时c(NO)=2xmol/L,则c( N2)=c(O2)= (0.15-x)mol/L,由于在2260℃时该反应的化学平衡常数是1,c2(NO)=" c(" N2)·c(O2),(2x)2=(0.15-x)2,解得x="0.05mol/L," 则此时得到NO的物质的量是n(NO)= 0.05mol/L×2×2L=0.2mol;用N2表示的平均反应速率为V(N2)="x÷20s=" 0.05mol/L ÷20s ="0.0025" mol·L-1·s-1;(2) N2(g)+3H2(g)![]() 2NH3(g) △H<0的正反应是气体体积减小的反应,在其它条件不变时,增大压强,化学平衡正向移动,N2的转化率增大,在压强不变时,升高温度,化学平衡向吸热的逆反应方向移动,所以T1>T2;故A错误;B正确;温度T1>T2; (3) 在阴极N2获得电子,与其中的H+结合形成NH3,所以阴极的电极反应式为N2 + 6H+ + 6e- = 2NH3。 (4) ①-②×3+③×4,整理可得2N2(g) + 6H2O(l)
2NH3(g) △H<0的正反应是气体体积减小的反应,在其它条件不变时,增大压强,化学平衡正向移动,N2的转化率增大,在压强不变时,升高温度,化学平衡向吸热的逆反应方向移动,所以T1>T2;故A错误;B正确;温度T1>T2; (3) 在阴极N2获得电子,与其中的H+结合形成NH3,所以阴极的电极反应式为N2 + 6H+ + 6e- = 2NH3。 (4) ①-②×3+③×4,整理可得2N2(g) + 6H2O(l)![]() 4NH3(aq) + 3O2(g) △H =2△H1-3△H2+4△H3。
4NH3(aq) + 3O2(g) △H =2△H1-3△H2+4△H3。

 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。