题目内容
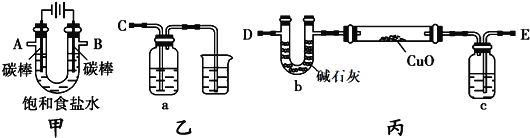
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:
Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)装置的连接顺序(按气体左右的方向)是____→_____→_____→_____→_______→_____→_____→_____(填各接口的编号)。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是__________________________________________________。
(3)Ⅳ处观察到的现象是___________________________________________。
(4)若II中反应在适当的反应状况下,反应达最大限度以后,下列说法正确的是__________。
A.SO2浓度必定等于O2浓度的两倍
B.SO2、O2、SO3的分子数之比是2∶1∶2
C.SO2与O2不再化合生成SO3
D.反应混合物各成分的百分组成不再变化
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会_______(填“增大”“不变”或“减小”)。
(6)用nmol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得III处增重mg,则本实验中SO2的转化率为______________________。(用n、m表示)
【答案】a h i b c f g d 先加热V2O5,后缓缓滴入浓硫酸 有无色(或白色)晶体(或固体)生成 D 减小 1-![]()
【解析】
(1)装置I制取的SO2与O2经干燥后进入装置II,经过催化氧化后得到SO2、O2及生成的SO3的混合气体;为测定SO2与SO3的量,SO3在装置IV中经过冰水冷凝,而SO2将被随后的装置III中的碱液吸收;接口的连接顺序为a h i b c f g d。
(2)SO2的催化氧化是需要在高温下进行的,为提高SO2的转化率,应先加热V2O5,后缓缓滴入浓硫酸。
(3)冰水的温度低于SO3的熔点,则在IV处可看到有无色(或白色)晶体(或固体)生成。
(4)反应达最大限度,说明反应达到平衡状态,
A.SO2和O2的浓度与起始加入量和反应转化量有关,两种浓度之间没有关系,A错误;
B.SO2、O2、SO3的分子数与起始加入量和反应转化量有关,三者分子数之间没有关系,B错误;
C.反应达到平衡状态时,反应没有停止,SO2与O2仍然继续化合生成SO3,C错误;
D. 反应达到平衡状态时反应混合物各成分的百分组成不再变化,D正确;
答案选D。
(5)在Ⅰ处用大火加热烧瓶时,生成SO2的量增多,对于可逆反应2SO2+O2![]() 2SO3,增大SO2的量,SO2的转化率会减小,氧气的转化率增大。
2SO3,增大SO2的量,SO2的转化率会减小,氧气的转化率增大。
(6)用nmol Na2SO3粉末与足量浓硫酸反应生成nmolSO2,III处增重m g,是部分转化后剩余SO2的质量,其物质的量为![]() mol,所以实验中SO2的转化率为(nmol-
mol,所以实验中SO2的转化率为(nmol-![]() mol)÷nmol=1-
mol)÷nmol=1-![]() 。
。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
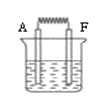
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。