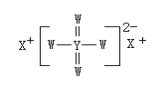
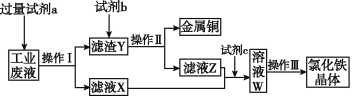
题目内容
【题目】电化学在化学工业有着广泛的应用,
(1)工业冶炼铝的化学方程式是______;
(2)工业级氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换法膜法电解提纯。电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
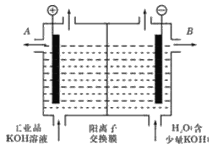
①该电解槽的阳极反应式是________;
②除去杂质后的氢氧化钾溶液从液体出口_______(填写“A”或“B”)导出。
(3)爱迪生蓄电池的反应式为:Fe+NiO2+2H2O![]() Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
Fe(OH)2+Ni(OH)2;高铁酸酸钠(Na2FeO4)是一种新型净水剂.用下面装置可以制取少量高铁酸钠。
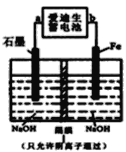
①此装置中爱迪生蓄电池的负极是________(填“a”或“b”),该电池工作一段时间后必须充电,充电时生成NiO2的反应类型是______。
②写出在用电解法制取高铁酸钠时,阳极的电极反应式_________。
【答案】(1)2Al2O3(熔融)![]() 4Al+3O2
4Al+3O2
(2)①4OH--4e-=2H2O+O2②B
(3)① a 氧化反应②![]()
【解析】
试题工业冶炼铝的化学方程式是2Al2O3(熔融)![]() 4Al+3O2↑;该电解槽中溶液中阴离子是氢氧根离子,故阳极反应为4OH--4e-=2H2O+O2↑;中间是阳离子交换膜,钾离子可以从左到右,右边阴极是氢离子放电,产生氢氧根离子,所以除去杂质的氢氧化钾溶液从右边B口导出;需要用爱迪生电池供电电解制取高铁酸钠,铁必须为阳极,石墨为阴极,爱迪生电池a为电源负极,充电时Ni(OH)2变成NiO2化合价升高失去电子,发生氧化反应;电解法制取高铁酸钠时,阳极的电极反应:
4Al+3O2↑;该电解槽中溶液中阴离子是氢氧根离子,故阳极反应为4OH--4e-=2H2O+O2↑;中间是阳离子交换膜,钾离子可以从左到右,右边阴极是氢离子放电,产生氢氧根离子,所以除去杂质的氢氧化钾溶液从右边B口导出;需要用爱迪生电池供电电解制取高铁酸钠,铁必须为阳极,石墨为阴极,爱迪生电池a为电源负极,充电时Ni(OH)2变成NiO2化合价升高失去电子,发生氧化反应;电解法制取高铁酸钠时,阳极的电极反应:![]()

练习册系列答案
相关题目