题目内容
12.研究NO2、SO2等大气污染气体的处理有重要意义.(1)NO2可用水吸收,相应的化学方程式为3NO2+H2O=2HNO3+NO;利用反应6NO2+8NH3$\frac{\underline{催化剂}}{△}$7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是6.72L.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ•mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8kJ•mol-1
(3)大气中NO2和CO2是形成酸雨的主要污染气体,某地酸雨中可能含有下列离子:Na+、Mg2+、NH4+、Cl-、SO32-、SO42-、NO3-和NO2-等.某研究小组取该地一定量的酸雨,浓缩后将所得试液分成4份,进行如下实验:
第一份滴加适量的淀粉KI溶液,呈蓝色;
第二份滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出;
第三份滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝;第四份加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色.
已知:Ksp(Ag2SO4)=1.20×10-5
请回答下列问题:
①该酸雨中肯定存在的离子有SO42-、NO3-、NH4+;肯定不存在的离子有SO32-、NO2-,说明其不存在的理由:SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4
溶液褪色.
②写出试液中滴加淀粉KI溶液所发生反应的离子方程式:6I-+2NO3-+8H+=3I2+2NO↑+4H2O.
(4)该研究小组为了探究NO参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2,该过程中发生的化学反应有2NO+O2=2NO2,NO2+SO2=SO3+NO,再喷射适量蒸馏水即得硫酸型酸雨.说明NO的作用:催化剂.
分析 (1)根据物质与水的反应物与生成物来书写化学反应方程式,再利用氧化还原反应中电子转移计算,然后来计算标准状况下气体的体积;
(2)利用盖斯定律来计算反应热;
(3)①滴加适量的淀粉KI溶液,呈蓝色,说明有NO3-,SO32-与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色,一定不含NO2-,若有NO2-,能使酸性KMnO4褪色,而氯离子的存在与否不能判断,因为硫酸根已经存在;
②根据单质碘能使淀粉KI溶液呈蓝色来分析;
(4)根据物质的性质来书写方程式,根据一氧化氮在反应中的特点来判断所起到的作用;
解答 解:(1)NO2与H2O反应的方程式为:3NO2+H2O═2HNO3+NO;6NO2+8NH3═7N2+12H2O,当反应中有1 mol NO2参加反应时,共转移了4 mol电子,故转移1.2mol电子时,消耗的NO2为1.2÷4×22.4L=6.72L.
故答案为:3NO2+H2O=2HNO3+NO;6.72;
(2)根据盖斯定律,将第二个方程式反写,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ•mol-1,故NO2+SO2?SO3+NO,△H=-41.8 kJ•mol-1;
故答案为:-41.8;
(3)①滴加适量的淀粉KI溶液,呈蓝色,说明在该酸性溶液中有一种能将碘离子氧化为碘单质的离子存在,而这样的离子只有NO3-,故一定含有NO3-,就一定不会含有SO32-,因为SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;滴加用盐酸酸化的BaCl2溶液,有白色沉淀析出,故一定含有SO42-;滴加NaOH溶液,加热,产生的气体能使湿润的红色石蕊试纸变蓝,则有氨气生成,故一定含有NH4+;加入足量硝酸酸化的AgNO3溶液,有沉淀产生,静置,在上层清液中滴加酸性KMnO4溶液,不褪色,一定不含NO2-,若有NO2-,能使酸性KMnO4褪色,而氯离子的存在与否不能判断,因为硫酸根已经存在,
故答案为:SO42-、NO3-、NH4+;SO32-、NO2-;SO32-具有较强的还原性,酸性条件下,与NO3-不能共存;若有NO2-,能使酸性KMnO4溶液褪色;
②硝酸氧化碘离子的离子方程式为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O,故答案为:6I-+2NO3-+8H+=3I2+2NO↑+4H2O;
(4)一氧化氮具有还原性,很容易被氧气氧化,方程式为:2NO+O2=2NO2,二氧化氮能将二氧化硫氧化,方程式为NO2+SO2=SO3+NO,整个过程一氧化氮的质量没有变化,故在反应中作催化剂,
故答案为:催化剂.
点评 本题考查了盖斯定律的应用、方程式的书写、离子共存和氧化还原反应、催化剂等,题目难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力,注意把握常见离子的检验方法以及物质的性质.

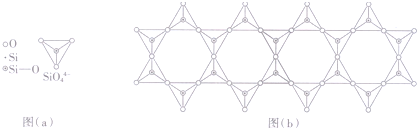
| A. | 60.0g水晶晶体中,含有“Si-O”键的数目为NA | |
| B. | 7.8 g过氧化钠晶体中含有阴离子的数目为0.2NA | |
| C. | 18.4 g甲苯中含有碳碳双键的个数为0.6 NA | |
| D. | 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA |
| A. | 离子晶体中,一定不存在共价键 | B. | 原子晶体中,只存在共价键 | ||
| C. | 金属晶体的熔沸点均很高 | D. | 稀有气体的原子能形成分子晶体 |




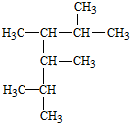 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷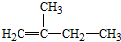 2-甲基-1-丁烯
2-甲基-1-丁烯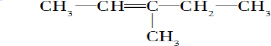 .
. .
.