题目内容
17.以明矾[KAl(SO4)2•12H2O]为原料制备Al、K2SO4和H2SO4的工艺流程如下: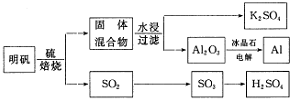
依据上述流程图回答下列问题:
(1)写出明矾和硫单质混合焙烧发生反应的化学方程式4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+2K2SO4+9SO2↑+48H2O.
(2)从水浸后的滤液中得到K2SO4晶体的方法是蒸发浓缩、冷却结晶、过滤,实验室在蒸发浓缩过程中用到的主要仪器有蒸发皿、玻璃棒、酒精灯、三脚架.
(3)电解Al2O3时加入冰晶石的作用是降低Al2O3的熔点,节约能源.
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2.
(5)焙烧产生的SO2可用于制硫酸.已知25℃,101kPa时:
2SO2(g)+O2(g)?2SO3(g)△H1=-197.0kJ•mol-1
H2O(g)═H2O(l)△H2=-44kJ•mol-1
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1
则SO3(g)和H2O(l)反应的热化学方程式是SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1.
(6)焙烧948吨明矾(M=474g•mol-1),若SO2的利用率为96%,则可生产多少吨质量分数为98%的硫酸?
分析 (1)“焙烧”过程中得到SO2与固体混合物,而固体混合物进行水浸,过滤得到Al2O3与K2SO4,则焙烧”过程中得到SO2、Al2O3、K2SO4,同时有水生成,配平是化学方程式;
(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,实验室在蒸发浓缩过程中用到的主要仪器有:蒸发皿、玻璃棒、酒精灯、三脚架;
(3)Al2O3的熔点很高,电解时加入冰晶石降低Al2O3的熔点,可以节约能源;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,发生还原反应,则Al发生氧化反应,碱性条件下得到NaAlO2,配平书写方程式;
(5)SO3(g)和H2O(l)发生反应为:SO3+H2O═H2SO4,根据盖斯定律,由已知热化学方程式乘以合适的系数进行加减,构造目标热化学方程式,反应热也进行相应的运算;
(6)将SO2的利用率转化为KAl(SO4)2•12H2O的利用率,由焙烧”过程中反应方程式,及硫元素守恒,可得关系式:4KAl(SO4)2•12H2O~9H2SO4,据此计算.
解答 解:(1)“焙烧”过程中得到SO2与固体混合物,而固体混合物进行水浸,过滤得到Al2O3与K2SO4,则焙烧”过程中得到SO2、Al2O3、K2SO4,同时有水生成,发生反应为:4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+2K2SO4+9SO2↑+48H2O,
故答案为:4KAl(SO4)2•12H2O+3S$\frac{\underline{\;高温\;}}{\;}$2Al2O3+2K2SO4+9SO2↑+48H2O;
(2)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤等操作,实验室在蒸发浓缩过程中用到的主要仪器有:蒸发皿、玻璃棒、酒精灯、三脚架,
故答案为:冷却结晶;蒸发皿、玻璃棒、酒精灯、三脚架;
(3)Al2O3的熔点很高,电解时加入冰晶石降低Al2O3的熔点,可以节约能源,
故答案为:降低Al2O3的熔点,节约能源;
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,发生还原反应,则Al发生氧化反应,碱性条件下得到NaAlO2,该电池反应的化学方程式是:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2,
故答案为:Al+3NiO(OH)+NaOH+H2O=3Ni(OH)2+NaAlO2;
(5)SO3(g)和H2O(l)发生反应为:SO3+H2O═H2SO4,
已知:①2SO2(g)+O2(g)?2SO3(g)△H1=-197.0kJ•mol-1
②H2O(g)═H2O(l)△H2=-44kJ•mol-1
③2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJ•mol-1
根据盖斯定律,(③-①)×$\frac{1}{2}$-②得:SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1,
故答案为:SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1;
(6)设可生产x吨质量分数为98%的硫酸,则:
4KAl(SO4)2•12H2O~9H2SO4,
4×474 9×98
948t×96% xt×98%
所以(4×474):(9×98)=(948t×96%):(xt×98%)
解得x=432,
答:可生产432吨质量分数为98%的硫酸.
点评 本题考查实验制备方案、物质的分离提纯、原电池反应式书写、热化学方程式书写、化学计算等,是对学生综合能力的考查,需要学生具备扎实的基础,(6)中注意利用关系式进行多步反应有损失率的计算,难度中等.

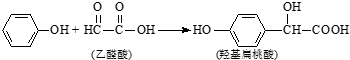
| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1mol Br2反应 | |
| C. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 | |
| D. | 羟基扁桃酸可以发生取代、氧化、加成等反应 |
| A. | C3H6 | B. | C4H8 | C. | C6H4Cl2 | D. | C5H12 |
| A. | 16 44 86 | B. | 16 28 58 | C. | 24 38 68 | D. | 24 32 56 |
| A. | 浓度均为0.1mol/L的HCN溶液和NaCN溶液等体积混合后溶液呈碱性c(CN-)>c(Na+)>c(HCN)>c(OH-)>c(H+) | |
| B. | pH=a的醋酸溶液,稀释100倍后,其pH=b,则a+2<b | |
| C. | c(NH4+)相同的①氯化铵②硫酸氢铵③次氯酸铵④碳酸铵四种溶液中pH:④>②>①>③ | |
| D. | pH=5的H2S溶液中:c(HS-)<c(H+)=1×10-5mol/L |
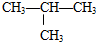 ⑤
⑤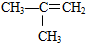
 锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.
锂亚硫酰氯(Li-SOCl2)电池具有能量密度高、工作电压和放电电压平稳、工作温度范围宽及贮存寿命长等优点,在航海、医疗及井下油田设备等方面的应用广泛.