题目内容
4.第四周期的过渡元素在工业、农业、科学技术以及人类生活等方面有重要作用.其 中Ni-Cr-Fe合金是常用的电热元件材料.请回答:(1)基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2或[Ar]3d84s2;第二周期中基态原子未成对电子数与Ni相同且电负性大的元素为O.金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni( CO)4,该分子呈正四面体构型.试推测Ni(CO)4的晶体类型为分子晶体,Ni(CO)4易溶于下列BC(填选项字母)中.
A.水 B.四氯化碳 C.苯 D.硫酸镍溶液
( 2)FeO、NiO晶体中r(Ni2+)和r(Fe2+)分别为69pm和78pm,则熔点NiO>FeO(填“>”或“<”),原因为r(Ni2+)小于r(Fe2+),NiO的晶格能大于FeO;黄血盐是一种配合物,其化学式为K4[Fe(CN)6]•3H2O,该配合物中配体的化学式为CN-,黄血盐溶液与稀硫酸加热时发生非氧化还原反应,生成硫酸盐和一种与该配体互为等电子体的气态化合物,该反应的化学方程式为K4[Fe(CN)6].3H2O+6H2SO4+3H2O$\frac{\underline{\;加热\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑.
(3)酸性227能氧化硝基苯酚,邻硝基苯酚和对硝基苯酚在20℃水中的溶解度之比为0.39,其原因为邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度.
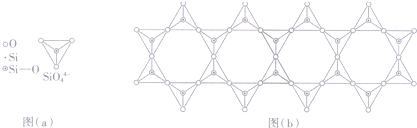
(4)在铬的硅酸盐中,4-四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大结构型式.图(b)为一种链状结构的多硅酸根,其中Si原子的杂化形式为sp3,其化学式为SiO32-.
分析 (1)Ni是28号元素,核外有28个电子,分四层排布;Ni有2个未成对电子根据第二周期元素的电子排布分析;沸点较低的晶体一般为分子晶体,分子晶体一般易溶于有机溶剂;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,由于离子电荷相同,离子半径越大,晶格能越小,熔点越低;K4[Fe(CN)6]•3H2O中CN-为配体;K4[Fe(CN)6].3H2O与H2SO4在加热条件下反应,没有元素化合价的变化,则生成K2SO4、FeSO4、(NH4)2SO4、CO;
(3)形成分子间氢键能增大物质的溶解性,形成分子内氢键,减小物质的溶解性;
(4)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;根据图(b)的一个结构单元中含有1个硅、3个氧原子,化学式为SiO32-.
解答 解:(1)Ni是28号元素,核外有28个电子,分四层排布,其电子排布式为:1s22s22p63s23p63d84s2或[Ar]3d84s2;Ni有2个未成对电子,第二周期元素未成对电子数为2的元素有C、O,其中电负性大的是O;金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,应为分子晶体,呈正四面体构型,应为非极性分子,易溶于非极性溶剂;
故答案为:1s22s22p63s23p63d84s2或[Ar]3d84s2;O;分子晶体;BC;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO;K4[Fe(CN)6]•3H2O中CN-为配体;K4[Fe(CN)6].3H2O与硫酸在加热条件下反应生成K2SO4、CO、FeSO4、(NH4)2SO4,则其反应方程式为:K4[Fe(CN)6].3H2O+6H2SO4+3H2O$\frac{\underline{\;加热\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑;
故答案为:>;r(Ni2+)小于r(Fe2+),NiO的晶格能大于FeO;CN-;K4[Fe(CN)6].3H2O+6H2SO4+3H2O$\frac{\underline{\;加热\;}}{\;}$2K2SO4+FeSO4+3(NH4)2SO4+6CO↑;
(3)形成分子间氢键能增大物质的溶解性,形成分子内氢键,减小物质的溶解性,邻硝基苯酚形成分子内氢键,降低其在水中的溶解度,对硝基苯酚与水形成分子间氢键,增大了溶解度;
故答案为:邻硝基苯酚形成分子内氢键,降低其在水中的溶解度;对硝基苯酚与水形成分子间氢键,增大了溶解度;
(4)硅酸盐中的硅酸根(SiO44-)为正四面体结构,所以中心原子Si原子采取了sp3杂化方式;
根据图(b)的一个小的结构单元中含有1个硅,2个氧原子属于该结构,还有2个与其它结构单元共用,则O原子数为2+2×$\frac{1}{2}$=3,所以化学式为SiO32-;
故答案为:sp3;SiO32-.
点评 本题考查较为综合,题目难度较大,涉及电子排布式、配位键、分子的性质、物质熔点的比较、物质结构图的分析应用等问题,注意电子排布式的书写方法,把握杂化类型的判断,为物质结构与性质经常考查问题.

| A. | 0.01mol•L-1H2S溶液:c(H+)>c(HS-)>c(S2-)>c(H2S)>c(OH-) | |
| B. | 0.1 mol•L-1NaHSO3溶液:c(Na+)+c(H+)<c(HSO3-)+c(SO32-)+c(OH-) | |
| C. | 等物质的量的NH4Cl和NaCl的混合溶液:c(NH4+)+c(NH3•H2O)+c(Na+)=2c(Cl-) | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-10的Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(10-2-10-12) mol•L-1 |
| A. | 标准状况下,用一充满氨气的干燥烧瓶做喷泉实验,当水充满整个烧瓶后(假设溶液不外溢),烧瓶内氨水的物质的量的浓度为$\frac{1}{22.4}$ mol/L | |
| B. | 氨很容易液化,因此氨常用作制冷剂 | |
| C. | SO3溶于水能导电,所以SO3是电解质 | |
| D. | 浓硝酸在光照条件下变黄,说明浓硝酸不稳定,生成的有色产物能溶于浓硝酸 |
| A. | 6 s | B. | 4 s | C. | 3 s | D. | 2 s |
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 C>D>A>B |

 、
、 、
、 .
.