题目内容
3.已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它和A、B、C可分别形成电子总数相等的三种分子.请回答:(1)写出工业生产中BD3与氧气反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O
(2)你认为B、C、D元素形成的化合物之间能否不能 (选填“能”或“不能”)发生下面的反应:BC+BD3→DBC2+D2C,理由是反应中只有N元素化合价的升高,而没有元素化合价的降低
(3)①恒温恒压下,在一定体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g)?4AC2(g)+B2(g)在上述条件下,向容器中充入AC和 BC2各1mol达平衡时,生成AC2和B2共a mol,则AC的转化率是80a%(用含a的代数式表示).
②若维持温度不变,在一个与①反应前的体积相同且容积固定的密闭容器中发生①中所述的化学反应,开始时仍向容器中充入AC和 BC2各1mol,达平衡时生成AC2和B2共b mol,将b与①中的a进行比较,则a>b(填“>”、“<”或“不能确定”).
分析 A、B、C是第二周期的非金属元素,其原子序数依次增大,它们的原子序数依次增大,它们之间可以形成AC和BC以及AC2和BC2分子,则A为C、B为N、C为O;D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子,则D为H元素.
(1)工业生产中NH3与氧气在催化剂条件下反应生成NO与水;
(2)反应中只有N元素化合价的升高,而没有元素化合价的降低,反应不能发生;
(3)Ⅰ、根据方程式可知,AC2和B2的物质的量之比为4:1,故生成B2共为0.2a mol,根据方程式计算参加反应的AC的物质的量,再根据转化率定义计算;
Ⅱ、Ⅰ中为恒温恒压,Ⅱ中为恒温恒容,随反应进行压强降低,相当于在Ⅰ的基础上降低压强,反应物的转化率降低,据此判断.
解答 解:A、B、C是第二周期的非金属元素,其原子序数依次增大,它们的原子序数依次增大,它们之间可以形成AC和BC以及AC2和BC2分子,则A为C、B为N、C为O;D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子,则D为H元素.
(1)工业生产中NH3与氧气在催化剂条件下反应生成NO与水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)反应中只有N元素化合价的升高,而没有元素化合价的降低,反应不能发生,
故答案为:不能;反应中只有N元素化合价的升高,而没有元素化合价的降低;
(4)Ⅰ、根据方程式可知,AC2和B2的物质的量之比为4:1,故生成B2共为amol×$\frac{1}{5}$0.2a mol,根据方程式可知参加反应的AC的物质的量为4×0.2amol=0.8 amol,故AC的转化率为$\frac{0.8amol}{1mol}$×100%=80a%,
故答案为:80a%;
Ⅱ、Ⅰ中为恒温恒压,Ⅱ中为恒温恒容,随反应进行压强降低,相当于在Ⅰ的基础上降低压强,平衡向逆反应方向移动,反应物的转化率降低,故生成成AC2和B2的物质的量减小,故a>b,
故答案为:>.
点评 本题考查元素推断、氧化还原反应、化学平衡有关计算等,难度中等,推断元素是解题关键,需要学生对元素化合物知识熟练掌握,(3)中Ⅱ注意利用等效思想构建平衡建立的途径进行比较.

| A. | Ba2+、NO3-、NH4+、Cl- | B. | Mg2+、NH4+、SO42-、K+ | ||
| C. | K+、Ba2+、Cl-、HSO3- | D. | Ca2+、HCO3-、NH4+、AlO2- |
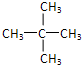
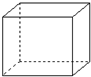 有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为
有机物的结构可用“键线式”简化表示.例如CH3-CH=CH-CH3可简写为  .“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图:
.“立方烷”是一种新合成的烃,其分子为正方体结构,其碳架结构如图: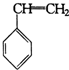 B.
B. 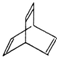 C.
C.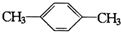 D.
D.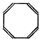
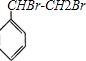 .
.
 ⑤
⑤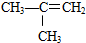
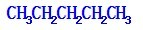 、
、 、
、 .
.