题目内容
2.某化学反应 3A(g)?2B(g)+D(g),在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如下表:| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内平均速率v(A)为0.03 mol/(L•min)
(2)在实验 2,A 的初始浓度 C22.0 mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是温度升高,A的浓度增大,平衡向吸热方向移动
(5)该反应化学平衡常数表达式为$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
分析 (1)根据v=$\frac{△c}{△t}$计算v(A);
(2)实验1、2温度相同,平衡常数相同,平衡时A的浓度均为0.8mol/L,则起始浓度相等,实验2到达平衡时间较短,反应速率较快,应使用催化剂;
(3)实验1、3温度相同,平衡常数相同,平衡时实验3中的A的浓度较大,则平衡时生成物浓度也较大,则平衡时实验3中A的浓度变化量大,实验3中A的起始浓度比实验1中大,故30min内实验3中A的浓度变化量较大;
(4)A的起始浓度相等,实验4中平衡时A的浓度较大,说明升高温度平衡逆向移动;
(5)平衡常数是指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比.
解答 解:(1)在实验 1,反应在10min~20min 内△c(A)=(1.6-1.3)mol/L=0.3mol/L,故v(A)=$\frac{0.3mol/L}{20min-10min}$=0.03mol/(L.min),
故答案为:0.03;
(2)实验1、2温度相同,平衡常数相同,平衡时A的浓度均为0.8mol/L,则起始浓度相等,即A 的初始浓度 C2=2.0mol/L,实验2到达平衡时间较短,反应速率较快,应使用催化剂,
故答案为:2.0;使用催化剂;
(3)实验1、3温度相同,平衡常数相同,平衡时实验3中的A的浓度较大,则平衡时生成物浓度也较大,则平衡时实验3中A的浓度变化量大,实验3中A的起始浓度比实验1中大,即C3>2.0mol/L,故30min内实验3中A的浓度变化量较大,故反应速率v3>v1,
故答案为:>;>;
(4)A的起始浓度相等,实验4中平衡时A的浓度较大,说明升高温度平衡逆向移动,而升高温度平衡向吸热反应移动,故正反应为放热反应,
故答案为:放热;温度升高,A的浓度增大,平衡向吸热方向移动;
(5)3A(g)?2B(g)+D(g)的平衡常数表达式K=$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$,
故答案为:$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
点评 本题考查化学平衡计算与影响因素,侧重考查学生对数据的分析处理能力,难度中等.

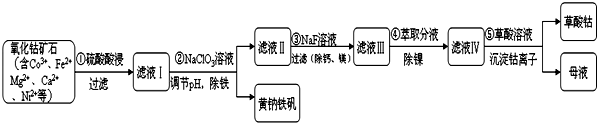
(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为-200目.
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
(3)Ⅰ.步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式并标出电子转移方向和数目
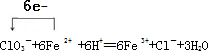 .
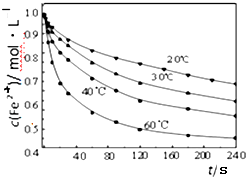
.Ⅱ.探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果如图,请从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)=0.25 mol•L-1•min-1.
(4)请写出步骤 ③中除去镁离子的离子反应方程式Mg2++2F-=MgF2↓.
(5)若要检验黄钠铁矾[Na2 Fe6(SO4)4(OH)12]中含有的金属元素,请简述实验方案:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在.
(6)从绿色化学角度分析,母液中可循环利用的物质为硫酸(填写名称).
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g)△H1
反应II:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是Ⅰ(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是d.
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g )═CO2(g )+2H2O(l)△H1=-726.52 kJ/mol.
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题:
①通入甲醇蒸气的电极应为负极(填写“正”或“负”),该电极上发生的电极反应是b(填字母代号).
a.2CH3OH-12e-+3O2═2CO2+4H2O
b.CH3 OH-6e-+8OH-═CO32-+6H2O
c.O2+2H2O+4e-═4OH-
d.O2-4e-+4H+═2H2O
②写出电极A的名称阴极.写出B电极的电极反应式4OH--4e-═O2↑+2H2O.
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是0.45mol.
| A. |  装置,除去SO2中混有的CO2 | |
| B. |  装置,用于亚硫酸钠和硫酸反应制取少量的SO2 | |
| C. |  装置,分离NH4Cl和Ca(OH)2固体 | |
| D. |  装置,做喷泉实验 |
 全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )
全溶解,所得溶液还能吸收0.56L氯气(STP),使其中的Fe2+全部转化为Fe3+。则该氧化物的化学式为( )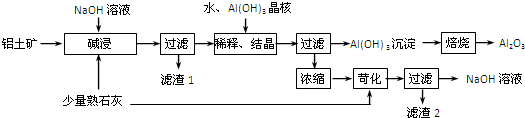
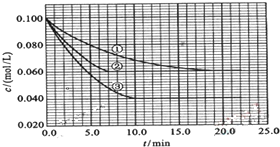 浓度为0.06mol/L.
浓度为0.06mol/L.