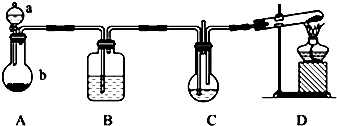
题目内容
13.某铝土矿中主要含有Al2O3、Al(OH)3、AlO(OH),还含有Fe2O3等杂质.利用拜耳法生产氧化铝的流程如图所示: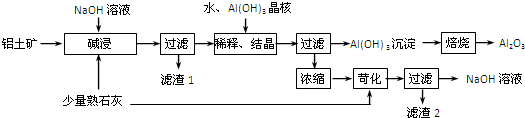
(1)碱浸时为提高铝土矿的浸出率可采取的措施是粉碎铝土矿,升高温度等.(答两点)
(2)AlO(OH)与NaOH反应的化学方程式为AlO(OH)+NaOH=NaAlO2+H2O.
(3)在稀释、结晶过程中,加Al(OH)3晶核的目的是促进Al(OH)3的析出.上述“稀释、结晶”工艺,也可用通入足量的某气体的方法来代替.通入气体时发生反应的离子方程式是AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓.
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,该杂质可通过苛化反应除去,写出苛化反应的化学方程式:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(5)该生产流程能实现NaOH填化学式)的循环利用.
(6)氧化铝是工业上冶炼铝的原料,用氧化铝电解制备金属铝时需加入冰晶石(Na3AlF6)作助熔剂,写出用NaF和Al2(SO4)3反应制备冰晶石的化学方程式为12NaF+Al2(SO4)3═2Na3AlF6+3Na2SO4.
分析 铝土矿用强碱溶液进行转化成偏铝酸盐,加入Al(OH)3晶核促进Al(OH)3的析出,加水稀释也是促进偏铝酸根离子的水解,最后滤出氢氧化铝,然后焙烧氢氧化铝得到三氧化二铝,
(1)矿石的颗粒大小、温度及是否搅拌等会影响浸取率,据此答题;
(2)AlO(OH)与NaOH反应,最后得到偏铝酸钠,钠和铝之比为1:1,所以AlO(OH)与NaOH是1:1反应;
(3)越稀越水解,加水稀释促进偏铝酸根离子的水解,也可以用偏铝酸盐与二氧化碳气体反应制得;
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子;
(5)后续反应中生成氢氧化钠,而前阶段是用氢氧化钠溶解铝土矿;
(6)NaF和Al2(SO4)3反应可生成Na3AlF6和Na2SO4;
解答 解:铝土矿用强碱溶液进行转化成偏铝酸盐,加入Al(OH)3晶核促进Al(OH)3的析出,加水稀释也是促进偏铝酸根离子的水解,最后滤出氢氧化铝,然后焙烧氢氧化铝得到三氧化二铝,
(1)为提高铝土矿的浸出率可采取的措施是粉碎铝土矿,升高温度,搅拌等,
故答案为:粉碎铝土矿,升高温度等;
(2)AlO(OH)与NaOH反应,最后得到偏铝酸钠,钠和铝之比为1:1,所以AlO(OH)与NaOH是1:1反应,即AlO(OH)+NaOH=NaAlO2+H2O,
故答案为:AlO(OH)+NaOH=NaAlO2+H2O;
(3)越稀越水解,加水稀释促进偏铝酸根离子的水解,也可以用偏铝酸盐与二氧化碳气体反应制得,反应的离子方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(4)浓缩所得的NaOH溶液由于吸收了空气中的CO2而含有杂质,杂质是碳酸钠,碳酸钠与氢氧化钙反应生成苛性钠,从而除去碳酸根离子,方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(5)后续反应中生成氢氧化钠,而前阶段是用氢氧化钠溶解铝土矿,该生产流程能实现的循环利用是NaOH,
故答案为:NaOH;
(6)NaF和Al2(SO4)3反应可生成Na3AlF6和Na2SO4,方程式为12NaF+Al2(SO4)3=2Na3AlF6+3Na2SO4,
故答案为:12NaF+Al2(SO4)3═2Na3AlF6+3Na2SO4.
点评 以三氧二化铝的制备为载体,考查铝及其化合物性质、离子方程式、对工艺流程的理解、除杂等,难度中等,关键在于对工艺流程的理解和知识的迁移运用.

| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内平均速率v(A)为0.03 mol/(L•min)
(2)在实验 2,A 的初始浓度 C22.0 mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是温度升高,A的浓度增大,平衡向吸热方向移动
(5)该反应化学平衡常数表达式为$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
| A. | 白磷的分子式:P | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氟离子的结构示意图: | D. | 过氧化氢的电子式: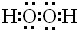 |




 .
.