题目内容
11.配平以下氧化还原反应的方程式:(1)2KMnO4+5H2C2O4+3H2SO4-10CO2+1K2SO4+2MnSO4+8H2O,当KMnO4消耗0.05mol时,产生的CO2的体积为5.6L(标准状况);
(2)6NaOH+3S-2Na2S+1Na2SO3+3H2O.
分析 (1)高锰酸钾有强氧化性,作氧化剂,K2C2O4中C的化合价为+3价,CO2中C的化合价为+4价,K2C2O4作还原剂,由高锰酸钾生成硫酸锰Mn元素化合价降低5,据氧化还原反应中电子得失守恒,再结合反应前后元素守恒配平化学方程式;据化学方程式计算生成二氧化碳的体积;
(2)该反应为S元素的歧化反应,S从0价变为-2价和+4价,作还原剂和氧化剂的S的物质的量之比为2:1,结合原子守恒配平.
解答 解:(1)该反应中化合价的变化为:KMnO4→MnSO4,Mn元素由+7价→+2价,一个KMnO4分子得5个电子;K2C2O4→CO2,C元素由+3价→+4价,一个K2C2O4失去2个电子,所以得失电子的最小公倍数为10,所以KMnO4的计量数为2,K2C2O4的计量数为5,其它元素根据原子守恒配平化学方程式为.2KMnO4+5H2C2O4+3H2SO4=10CO2+1K2SO4+2MnSO4+8H2O,据反应方程式可知,每有2mol高锰酸钾反应,生成10mol二氧化碳,则有0.05mol高锰酸钾反应,生成二氧化碳的体积为$\frac{0.05mol×10}{2}×22.4L/mol$=5.6L,
故答案为:2、5、3、10、1、2、8;5.6;
(2)S从0价变为-2价和+4价,作还原剂和氧化剂的S的物质的量之比为2:1,据得失电子守恒,S的化学计量数为3,硫化钠的化学计量数为2,亚硫酸钠的化学计量数为1,据Na原子守恒,NaOH的化学计量数为6,据H原子守恒,水的化学计量数为3,故答案为:6、3、2、1、3.
点评 本题考查了氧化还原反应反应的配平,要以氧化还原反应中得失电子相等为依据配平.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案
相关题目
2.某化学反应 3A(g)?2B(g)+D(g),在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内平均速率v(A)为0.03 mol/(L•min)
(2)在实验 2,A 的初始浓度 C22.0 mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是温度升高,A的浓度增大,平衡向吸热方向移动
(5)该反应化学平衡常数表达式为$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内平均速率v(A)为0.03 mol/(L•min)
(2)在实验 2,A 的初始浓度 C22.0 mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是温度升高,A的浓度增大,平衡向吸热方向移动
(5)该反应化学平衡常数表达式为$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
3.下列化学用语的表达或使用正确的是( )
| A. | 白磷的分子式:P | B. | 次氯酸的结构式:H-Cl-O | ||
| C. | 氟离子的结构示意图: | D. | 过氧化氢的电子式: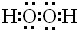 |
20.用10mL的0.1mol•L-1 BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐溶液的物质的量浓度之比是( )
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
1.对已达化学平衡的下列反应 2X(g)+Y(g)?2Z(g),减小压强时,对反应产生的影响是( )
| A. | 逆反应速率增大,正反应速率减小 | B. | 逆反应速率减小,正反应速率增大 | ||
| C. | 逆反应速率先增大后减小 | D. | 正反应速率先减小后增大 |

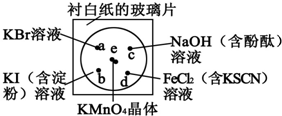 某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)
某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol•L-1的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好.(已知2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O)