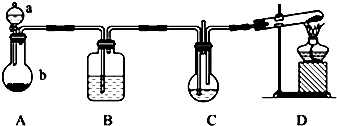
题目内容
17.在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
(1)写出该反应的平衡常数表达式:K=$\frac{c(C)}{c(A)×{c}^{2}(B)}$;
(2)与①比较,②和③分别仅改变一种反应条件.所改变的条件分别是:②使用了催化剂; ③升高温度;
(3)实验②平衡时B的转化率为40%;实验③平衡时C的
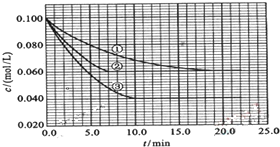 浓度为0.06mol/L.
浓度为0.06mol/L.
分析 (1)平衡常数指:一定温度下,可逆反应到达平衡时,生成物浓度系数次幂乘积与反应物浓度系数次幂乘积的比;
(2)与①比较,②的反应速率加快,平衡不移动,应是使用催化剂;③的反应速率也加快,平衡时A的浓度减小,平衡发生移动,应是升高温度;
(3)根据A的浓度变化量计算△c(B)、△c(C),B的转化率=$\frac{B的浓度变化量}{B的起始浓度}$×100%,C的平衡浓度=C的起始浓度+C的浓度变化量.
解答 解:(1)A+2B?C的平衡常数表达式K=$\frac{c(C)}{c(A)×{c}^{2}(B)}$,故答案为:$\frac{c(C)}{c(A)×{c}^{2}(B)}$;
(2)与①比较,②的反应速率加快,平衡不移动,应是使用催化剂;③的反应速率也加快,平衡时A的浓度减小,平衡发生移动,应是升高温度,
故答案为:使用了催化剂;升高温度;
(3)实验②平衡时△c(A)=0.1mol/L-0.06mol/L=0.04mol/L,则△c(B)=2△c(A)=0.08mol/L,实验②平衡时B的转化率=$\frac{0.08mol/L}{0.2mol/L}$×100%=40%;
实验③平衡时△c(A)=0.1mol/L-0.04mol/L=0.06mol/L,则△c(C)=△c(A)=0.06mol/L,
故答案为:40%;0.060mol/L.
点评 本题考查化学平衡计算与影响因素、平衡常数,比较基础,注意对基础知识的理解掌握.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列各组溶液只用水和试管,达不到鉴别目的是( )
| A. | Na2O2、KCl、CuSO4、NaNO3四种固体 | |
| B. | CCl4、乙醇、苯三种液体 | |
| C. | CaCO3、NaHSO4、Al2S3、Mg(OH)2四种固体 | |
| D. | NaCl、Na2SO4、AlCl3、MnO2四种固体 |
12. 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
①10min~20min以v(CO2) 表示的反应速率为0.009 mol•L-1•min-1.
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是CD(填序号字母).
A.容器内压强保持不变 B. 2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
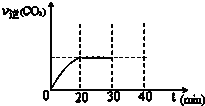
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是减小CO2 的浓度.请在图中画出30min至40min的变化曲线.
 随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%.目前,消除大气污染有多种方法.(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染.已知:
①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
③H2O(g)═H2O(l)△H=-44.0kJ•mol-1
写出CH4(g)与NO2(g)反应生成N2 (g)、CO2 (g)和H2O(1)的热化学方程式CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-955kJ•mol-1.
(2)利用Fe2+、Fe3+的催化作用,常温下可将SO2转化为SO42-,从而实现对SO2的治理.已知含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,则另一反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(3)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g)?N2 (g)+CO2 (g).某研究小组向密闭的真空容器中(假设容器体积不变,固体试样体积忽略不计)加入NO和足量的活性炭,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
②根据表中数据,计算T1℃时该反应的平衡常数为0.56(保留两位小数).
③一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”、“不变”或“减小”).
④下列各项能作为判断该反应达到平衡的是CD(填序号字母).
A.容器内压强保持不变 B. 2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
⑤30min末改变某一条件,过一段时间反应重新达到平衡,则改变的条件可能是减小CO2 的浓度.请在图中画出30min至40min的变化曲线.
2.某化学反应 3A(g)?2B(g)+D(g),在四种不同条件下进行,B、D的起始浓度为0.反应物A 的浓度 c 随时间 t 的变化情况如下表:
根据上述数据,完成下列填空:
(1)在实验 1,反应在10min~20min 内平均速率v(A)为0.03 mol/(L•min)
(2)在实验 2,A 的初始浓度 C22.0 mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是温度升高,A的浓度增大,平衡向吸热方向移动
(5)该反应化学平衡常数表达式为$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
| 实验序号 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
(1)在实验 1,反应在10min~20min 内平均速率v(A)为0.03 mol/(L•min)
(2)在实验 2,A 的初始浓度 C22.0 mol/L,反应经 20min 就达到平衡,可推测实验 2 中还隐含的条件是使用催化剂.
(3)设实验 3 的反应速率为 v3,实验 1 的反应速率为 v1,则 v3>v1(填<、>或=),且C3> 2.0mol/L (填<、>或=)
(4)比较实验 4 和实验 1,可推测正反应是放热反应(填吸热或放热).理由是温度升高,A的浓度增大,平衡向吸热方向移动
(5)该反应化学平衡常数表达式为$\frac{{c}^{2}(B)×c(D)}{{c}^{3}(A)}$.
9.Ⅰ、氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应.请回答下列问题:
(1)氯水久置后会变质,请分析变质的原因.(请用方程式及必要文字说明分析)氯气与水反应:H2O+Cl2?HCl+HClO,HClO不稳定分解:2HClO═2HCl+O2↑
(2)如果增大氯气的压强,氯气在水中的溶解度将增大(填“增大”“减小”或“不变”)
Ⅱ、在2L恒容的密闭容器中,加入4mol SO3(g),在某温度下使其反应,反应至4min时,氧气的浓度为0.5mol/L,当反应到8min时,反应到达平衡.
(1)0min~4min内生成O2的平均速率:v(O2)=0.125mol/(L•min).
(2)若8分钟达到平衡时,测得SO3浓度为0.04mol/L.若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.04mol/L的是BD
(1)氯水久置后会变质,请分析变质的原因.(请用方程式及必要文字说明分析)氯气与水反应:H2O+Cl2?HCl+HClO,HClO不稳定分解:2HClO═2HCl+O2↑
(2)如果增大氯气的压强,氯气在水中的溶解度将增大(填“增大”“减小”或“不变”)
Ⅱ、在2L恒容的密闭容器中,加入4mol SO3(g),在某温度下使其反应,反应至4min时,氧气的浓度为0.5mol/L,当反应到8min时,反应到达平衡.
(1)0min~4min内生成O2的平均速率:v(O2)=0.125mol/(L•min).
(2)若8分钟达到平衡时,测得SO3浓度为0.04mol/L.若起始时按下表数据投料,相同温度下达到平衡时,三氧化硫浓度大于0.04mol/L的是BD
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
7.下列化学用语表达正确的是( )
| A. | CO2分子比例模型: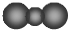 | |
| B. | 氨基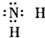 | |
| C. | 原子结构示意图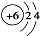 表示12C,也可以表示14C 表示12C,也可以表示14C | |
| D. | 乙炔的最简式 CH≡CH |