��Ŀ����
14�� ��Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��Դ��ȱ������������ٵ��ش����⣮�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������1����ҵ��һ������������ַ�Ӧ�ϳɼ״���
��ӦI��CO��g��+2H2��g��?CH3OH��g����H1
��ӦII��CO2��g��+3H2��g��?CH3OH��g��+H2O��g����H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����Ǣ��I������
���±����������Ƿ�ӦI�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
��ij�¶��£���2mol CO��6mol H2����2L���ܱ������У���ַ�Ӧ���ﵽƽ����c��CH3OH��=0.8mol/L����CO��ת����Ϊ80%����ʱ���¶�Ϊ250�棨���ϱ���ѡ��
�ܺ��¡�����ʱ�������������˵����ӦI�Ѿ��ﵽ��ѧƽ��״̬����d��
a�����������ʵ�Ũ�ȱ��ֲ��䣻 b��������ѹǿ���ֲ��䣻
c���ԣ�CO�����ĨT1/2�ԣ�H2������ �� d�������ڵ��ܶȱ��ֲ���
��2��25�桢101kPaʱ��ȼ��16gҺ��״�����CO2��H2O��l�����ų�������Ϊ363.26kJ��д���״�ȼ�յ��Ȼ�ѧ����ʽ��CH3OH��l��+$\frac{3}{2}$O2��g ���TCO2��g ��+2H2O��l����H1=-726.52 kJ/mol��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ�������һ��ȼ�ϵ�ص��Na2SO4��Һ��ͼ���£��������ͼʾ�ش��������⣺
��ͨ��״������ĵ缫ӦΪ��������д���������������õ缫�Ϸ����ĵ缫��Ӧ��b������ĸ���ţ���
a.2CH3OH-12e-+3O2�T2CO2+4H2O
b��CH3 OH-6e-+8OH-�TCO32-+6H2O
c��O2+2H2O+4e-�T4OH-
d��O2-4e-+4H+�T2H2O
��д���缫A������������д��B�缫�ĵ缫��Ӧʽ4OH--4e-�TO2��+2H2O��
�۵����Լ״�ȼ�ϵ������3.36L ����ʱ���ۺ�Ϊ��״�����������ϵ��Na2SO4��Һ��������������ʵ�����0.45mol��
���� ��1���١�ԭ�Ӿ��á���ָ�ڻ�ѧƷ�ϳɹ����У����õ�����ԭ���Ͼ����ܶ��ת�������ղ����У�
���ɱ����ݿ�֪���¶����ߣ�ƽ�ⳣ����С��˵��ƽ��������У�
�۰���Ӧ���ַ�Ӧ�ﵽƽ����c��CH3OH��=0.8mol/L�������ʵ���Ϊ1.6mol����
CO ��g��+2H2 ��g��?CH3OH ��g��
��ʼ����mol����2 6 0
�仯����mol����1.6 3.2 1.6
ƽ������mol����0.4 2.8 1.6
COת����=$\frac{����CO���ʵ���}{CO��ʼ���ʵ���}$��100%������K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$����ƽ�ⳣ���������ж��¶ȣ�
�ܿ��淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
��2��1mol�״�ȼ�շų�������Ϊ363.26kJ��$\frac{1mol��32g/mol}{16g/mol}$=726.52 kJ��ע�����ʵľۼ�״̬�뷴Ӧ����д�Ȼ�ѧ����ʽ��
��3����ԭ��ظ�������������Ӧ����Ӧ�м״�����������Ӧ��ʧȥ���ӣ���������������̼���������ˮ��
�ڵ�����A���ӵ�Դ��������AΪ������B���ӵ�Դ������BΪ�����������Ϸ���������Ӧ�����������ӷŵ�����������ˮ��
�۵����ܷ�ӦΪ2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2�������ݵ���ת���غ�����������������ʵ�����
��� �⣺��1���١�ԭ�Ӿ��á���ָ�ڻ�ѧƷ�ϳɹ����У����õ�����ԭ���Ͼ����ܶ��ת�������ղ����У�������Ӧ��֪����Ӧ����ԭ��������Ϊ100%�����ϡ�ԭ�Ӿ��á����ʴ�Ϊ����
���ɱ����ݿ�֪���¶����ߣ�ƽ�ⳣ����С��˵��ƽ��������У����������ȷ�Ӧ��������ȷ�Ӧ������H1��0���ʴ�Ϊ������
�۰���Ӧ���ַ�Ӧ�ﵽƽ����c��CH3OH��=0.8mol/L�������ʵ���Ϊ1.6mol����
CO ��g��+2H2 ��g��?CH3OH ��g��
��ʼ����mol����2 6 0
�仯����mol����1.6 3.2 1.6
ƽ������mol����0.4 2.8 1.6
CO��ת����=$\frac{1.6mol}{2mol}$��100%=80%��
��ʱ��ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$\frac{\frac{1.6}{2}}{\frac{0.4}{2}����\frac{2.8}{2}��^{2}}$��2.041�������¶�Ϊ250�棬
�ʴ�Ϊ��80%��250�棻
��a�����������ʵ�Ũ�ȱ��ֲ��䣬˵����Ӧ����ƽ�⣬��a��ȷ��
b���淴Ӧ���У��������������ʵ������У�������ѹǿ��С��������ѹǿ���ֲ��䣬˵����Ӧ����ƽ�⣬��b��ȷ��
c���ɷ���ʽ��֪�ԣ�CO�������T$\frac{1}{2}$�ԣ�H2�����������ԣ�CO�������T$\frac{1}{2}$�ԣ�H2��������˵���ԣ�CO�������T�ԣ�CO����������Ӧ����ƽ��״̬����c��ȷ��
d������������������䣬�����ݻ�ʼ�ղ��䣬�����ڵ��ܶ�ʼ�ձ��ֲ��䣬��d����
��ѡ��d��
��2��1mol�״�ȼ�շų�������Ϊ363.26kJ��$\frac{1mol��32g/mol}{16g/mol}$=726.52 kJ���Ȼ�ѧ����ʽΪ��CH3OH��l��+$\frac{3}{2}$O2��g ���TCO2��g ��+2H2O��l����H1=-726.52 kJ/mol��
�ʴ�Ϊ��CH3OH��l��+$\frac{3}{2}$O2��g ���TCO2��g ��+2H2O��l����H1=-726.52 kJ/mol��
��3����ԭ��ظ�������������Ӧ����Ӧ�м״�����������Ӧ���״������ĵ缫ӦΪ�������״�ʧȥ���ӣ���������������̼���������ˮ�������缫��ӦʽΪ��CH3 OH-6e-+8OH-�TCO32-+6H2O��
�ʴ�Ϊ������b��
�ڵ�����A���ӵ�Դ��������AΪ������B���ӵ�Դ������BΪ�����������Ϸ���������Ӧ�����������ӷŵ�����������ˮ�������缫��ӦʽΪ����4 OH--4 e-�TO2��+2H2O��
�ʴ�Ϊ��������4 OH--4 e-�TO2��+2H2O��
�۱���£�3.36L �������ʵ���Ϊ$\frac{3.36L}{22.4L/mol}$=0.15mol�������ܷ�ӦΪ2H2O$\frac{\underline{\;���\;}}{\;}$2H2��+O2�������ݵ���ת���غ㣬�����������������ʵ���Ϊ3��0.15mol=0.45mol��
�ʴ�Ϊ��0.45mol��
���� ���⿼�黯ѧƽ����㡢ƽ��״̬�жϡ��Ȼ�ѧ����ʽ��д���绯ѧ�ȣ��Ƕ�ѧ���ۺ��������飬��Ҫѧ���������ջ���֪ʶ�����Ӧ�ã��Ѷ��еȣ�

 ״Ԫ����ϵ�д�
״Ԫ����ϵ�д� ͬ������ϵ�д�
ͬ������ϵ�д�| ʵ����� |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
��1����ʵ�� 1����Ӧ��10min��20min ��ƽ������v��A��Ϊ0.03 mol/��L•min��
��2����ʵ�� 2��A �ij�ʼŨ�� C22.0 mol/L����Ӧ�� 20min �ʹﵽƽ�⣬���Ʋ�ʵ�� 2 �л�������������ʹ�ô�����
��3����ʵ�� 3 �ķ�Ӧ����Ϊ v3��ʵ�� 1 �ķ�Ӧ����Ϊ v1���� v3��v1���������=������C3�� 2.0mol/L ���������=��
��4���Ƚ�ʵ�� 4 ��ʵ�� 1�����Ʋ�����Ӧ�Ƿ��ȷ�Ӧ�������Ȼ���ȣ����������¶����ߣ�A��Ũ������ƽ�������ȷ����ƶ�
��5���÷�Ӧ��ѧƽ�ⳣ������ʽΪ$\frac{{c}^{2}��B����c��D��}{{c}^{3}��A��}$��
��1����ˮ���ú����ʣ���������ʵ�ԭ�����÷���ʽ����Ҫ����˵��������������ˮ��Ӧ��H2O+Cl2?HCl+HClO��HClO���ȶ��ֽ⣺2HClO�T2HCl+O2��
��2���������������ѹǿ��������ˮ�е��ܽ�Ƚ������������С�����䡱��
����2L���ݵ��ܱ������У�����4mol SO3��g������ij�¶���ʹ�䷴Ӧ����Ӧ��4minʱ��������Ũ��Ϊ0.5mol/L������Ӧ��8minʱ����Ӧ����ƽ�⣮
��1��0min��4min������O2��ƽ�����ʣ�v��O2��=0.125mol/��L•min����
��2����8���Ӵﵽƽ��ʱ�����SO3Ũ��Ϊ0.04mol/L������ʼʱ���±�����Ͷ�ϣ���ͬ�¶��´ﵽƽ��ʱ����������Ũ�ȴ���0.04mol/L����BD
| A | B | C | D | |
| SO3 | 0mol | 4mol | 2mol | 0mol |
| SO2 | 4mol | 1.5mol | 0mol | 4mol |
| O2 | 2mol | 0mol | 0mol | 4mol |
| A�� | ���ķ���ʽ��P | B�� | ������Ľṹʽ��H-Cl-O | ||
| C�� | �����ӵĽṹʾ��ͼ�� | D�� | ��������ĵ���ʽ��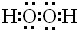 |
 ��
��