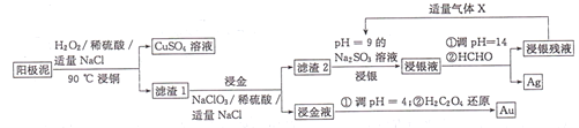
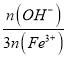题目内容
【题目】已知 A 是单质,A、B、C、D、E 五种物质均含同一种元素,X 是地壳中含量最多的元素形成的单质,相互转化关系如图所示.回答下列问题:

(1)通常情况下,若A为气体,C、D都是大气污染物;
①写出下列反应的化学方程式
B![]() C_________________
C_________________
E![]() C_________________
C_________________
②实验室中检验B的操作方法是_________________。
③标准状况下,将盛满D的试管倒扣在盛满水的水槽中,一段时间后,假定溶质不扩散,则试管中所得溶液的物质的量浓度为____________。
(2)通常情况下,若A为淡黄色固体:
①写出B与C反应的化学方程式:_______________________。
②将C通入溴水中的现象是______,发生反应的离子方程式是_______________________。
【答案】4NH3+5O2![]() 4NO+6H2O 3Cu+8HNO3=3Cu(NO3)2+2NO
4NO+6H2O 3Cu+8HNO3=3Cu(NO3)2+2NO![]() +4H2O 用湿润的红色石蕊试纸放在试管口变蓝或用蘸有浓盐酸的玻棒靠近气体有白烟
+4H2O 用湿润的红色石蕊试纸放在试管口变蓝或用蘸有浓盐酸的玻棒靠近气体有白烟 ![]() mol/L(或0.045mol/L) 2H2S+SO2=3S+2H2O 溴水褪色 SO2+Br2+2H2O=4H++SO42-+2Br-
mol/L(或0.045mol/L) 2H2S+SO2=3S+2H2O 溴水褪色 SO2+Br2+2H2O=4H++SO42-+2Br-
【解析】
X是地壳中含量最多的元素形成的单质,应为O2,符合转化关系的应为S或N2,
(1)通常情况下,若A为气体,C、D都是大气污染物,则A为N2,B为NH3,C为NO,D为NO2,E为HNO3;
(2)通常情况下,若A为淡黄色固体,应为S,则B为H2S,C为SO2,D为SO3、E为H2SO4,结合对应物质的性质以及题目要求解答该题。
(1)X是地壳中含量最多的元素形成的单质,应为O2,符合转化关系的应为S或N2,通常情况下,若A为气体,C、D都是大气污染物,则A为N2,B为NH3,C为NO,D为NO2,E为HNO3,
①B→C为氨气的催化氧化反应,方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
E→C为Cu和稀硝酸反应生成NO的反应,方程式为:3Cu+8HNO3=3Cu(NO3)2+2NO![]() +4H2O;
+4H2O;
②氨气为碱性气体,与水反应生成NH3H2O,电离子出OH-离子,溶液呈碱性,可用湿润的红色石蕊试纸检验,如试纸变蓝色,则说明有氨气生成;
③假设该容器的容积为3L,则二氧化氮的体积为3L,二氧化氮和水反应的方程式为:
3NO2+H2O=2HNO3+NO
3×22.4L 1×22.4L
3L 1L
反应前后气体的体积由3L变为1L,所以溶液的体积为2L;该溶液的溶质为硝酸,
3NO2+H2O=2HNO3+NO
3 2
![]() n(HNO3)
n(HNO3)
所以硝酸的物质的量n(HNO3)=![]() ×
×![]() =
=![]() mol,浓度为C=
mol,浓度为C=![]() =
=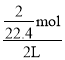
![]() mol/L=0.045mol/L;
mol/L=0.045mol/L;
(2)通常情况下,若A为淡黄色固体,应为S,则B为H2S,C为SO2,D为SO3、E为H2SO4,
①B与C为H2S和SO2的反应,方程式为2H2S+SO2=3S↓+2H2O,故答案为:2H2S+SO2=3S↓+2H2O;
②二氧化硫具有还原性,可与溴水发生氧化还原反应,反应的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-,可观察到溴水褪色,故答案为:溴水褪色;SO2+Br2+2H2O=4H++SO42-+2Br-。

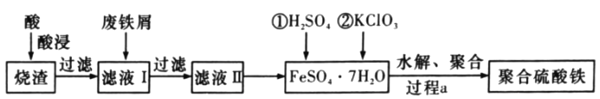
【题目】黄铁矿(主要成分FeS2)、黄铜矿(主要成分CuFeS2)均是自然界中的常见矿物资源。
(1)Stumm和Morgan提出黄铁矿在空气中氧化的四步反应如题20图-1所示:
① a反应中每生成1molFeSO4转移电子的物质的量为___mol。
② d反应的离子方程式为_______________。
(2)用细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高浸取速率,其原理如题20图-2
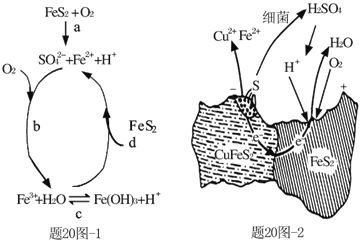
①冶炼过程中,正极周围溶液的pH___(选填:“增大”、“减小”或“不变”)
②负极产生单质硫的电极反应式为___。
这里,否则就错了!!阅后删除! |
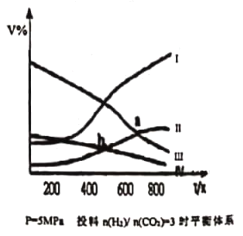
(3)煤炭中的硫主要以黄铁矿形式存在,用氢气脱除黄铁矿中硫的相关反应(见下表),其相关反应的平衡常数的对数值与温度的关系如题20图-3。
相关反应 | 反应热 | 平衡常数K |
FeS2(s) + H2(g) | ΔH1 | K1 |
1/2 FeS2(s) + H2(g) | ΔH2 | K2 |
FeS(s) + H2(g) | ΔH3 | K3 |
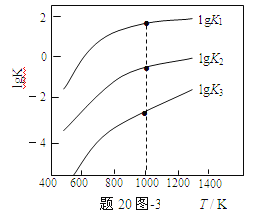
①上述反应中,ΔH1___0(选填:“>”或“<”)。
②提高硫的脱除率可采取的措施有___(举1例)。
③1000K时,平衡常数的对数lgK1、lgK2和lgK3之间的关系为___。
【题目】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度 e.同时加入0.2mol B、0.1mol D、0.1mol E
(3)写出下列电解质在水中的电离方程式:
CH3COOH:____________NaHSO4:______ NaHCO3:_________H2CO3:_________