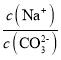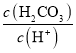题目内容
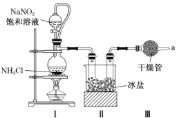
【题目】某铜钴矿石主要含有CoO(OH)、CoCO3、Cu2(OH)2CO3和SiO2,及一定量的Fe2O3、MgO和CaO等。由该矿石制Co2O3的部分工艺流程如下:
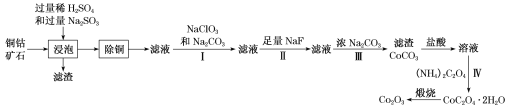
回答下列问题:
(1)“浸泡”过程中,钴(III)可转化为CoSO4,写出该转化的化学方程式:________。
(2)“除铜”若选用MnS,计算常温下该“除铜”反应的平衡常数K=________。[保留2位有效数字;已知常温下Ksp(MnS)=2.5×10–13,Ksp(CuS)=1.3×10–36]
(3)①步骤I中加入NaClO3反应的离子方程式为_______。
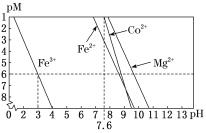
②常温下,溶液中金属离子(Mn+)的pM[pM=–lgc(Mn+)]随溶液pH变化关系如图所示,设加入NaClO3后,溶液中的c(CO2+)为0.1molL–1,依据如图分析,步骤I中加入Na2CO3调整溶液pH范围为_____。[当c(Mn+)≤10–6 molL–1,即认为该金属离子沉淀完全]
(4)步骤II中加入足量NaF的目的是________。
(5)过滤出的CoC2O42H2O固体经洗涤后,证明固体已洗净的操作为________。
(6)若某工厂用m1kg该铜钴矿石制备了m2kgCo2O3,假设产率为a,则该矿石中钴元素的百分含量为________。
【答案】2CoO(OH)+2H2SO4+Na2SO3=2CoSO4+Na2SO4+3H2O 1.9×1023 C1O3–+6Fe2++6H+=C1–+6Fe3++3H2O 3~7.6(或3≤pH<7.6) 形成MgF2、CaF2沉淀,除去溶液中的Mg2+、Ca2+ 取少量最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,则证明已洗净 ![]()
【解析】
分析流程图,将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡,目的是将CoO(OH)、CoCO3、Cu2(OH)2CO3等溶解,以提取目标元素,并把+3价Co还原为+2价,此时Fe2O3、MgO和CaO等也会溶解,铁由+3价还原为+2价。除铜步骤除去浸出液中含铜的化合物,之后向溶液中加入NaClO2溶液,将+2价铁氧化为+3价,再加入一定浓度的Na2CO3溶液,过滤,分离出去杂质元素铁,再向滤液中加入足量NaF溶液,将Ca2+、Mg2+转化为CaF2、MgF2除去。向其中的滤液中加入浓Na2CO3溶液得到CoCO3沉淀,再将该沉淀溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀,分离出沉淀,将其进行煅烧可得到Co2O3。据此分析解答。
(1)浸泡过程中为CoO(OH)与稀H2SO4、Na2SO3反应生成CoSO4的过程,根据原子守恒和电子得失守恒可得反应方程式为:2CoO(OH)+2H2SO4+Na2SO3=2CoSO4+Na2SO4+3H2O;答案为:2CoO(OH)+2H2SO4+Na2SO3=2CoSO4+Na2SO4+3H2O;
(2)用MnS“除铜”,发生反应为:MnS(s)+Cu2+(aq)![]() CuS(s)+Mn2+(aq),该反应的平衡常数K=
CuS(s)+Mn2+(aq),该反应的平衡常数K=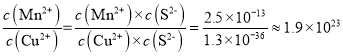 。答案为:1.9×1023;
。答案为:1.9×1023;
(3)①步骤I中加入NaClO3,是Fe2+与NaClO3反应,被氧化生成Fe3+,反应的离子方程式为:C1O3–+6Fe2++6H+=C1–+6Fe3++3H2O;答案为:C1O3–+6Fe2++6H+=C1–+6Fe3++3H2O;
②步骤Ⅰ中加入Na2CO3调整溶液pH值是为了除去铁元素,根据题给信息,当c(Mn+)≤10–6 molL–1,即认为该金属离子沉淀完全,故需调节pH≥3,即可保证Fe3+沉淀完全,同时不影响Co2+元素,需pH<7.6,则Na2CO3调整溶液pH范围为:3~7.6(或3≤pH<7.6);答案为:3~7.6(或3≤pH<7.6);
(4)步骤II中加入足量NaF,可将滤液中存在的Ca2+、Mg2+转化为CaF2、MgF2沉淀而除去,故步骤II中加入足量NaF的目的是:形成MgF2、CaF2沉淀,除去溶液中的Mg2+ 、Ca2+;答案为:形成MgF2、CaF2沉淀,除去溶液中的Mg2+ 、Ca2+;
(5)CoC2O42H2O晶体表面附着Cl-和NH4+,为看到明显现象应检验Cl-,可通过检验沉淀洗涤液中是否存在Cl-来判断沉淀是否洗涤干净,具体操作为:取少量最后一次洗涤液于试管中,加入硝酸酸化的硝酸银溶液,若无白色沉淀产生,则证明已洗净;
(6)设钴在该铜钴矿石中的百分含量为x,则![]() ,即
,即![]() 。答案为:
。答案为:![]() 。
。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案