��Ŀ����
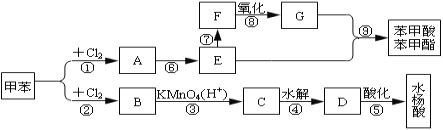
����Ŀ������ʪ�����մ������ࣨ��Ҫ����Cu��Ag��Au)����ȡAg��Au��������ͼ��ʾ��
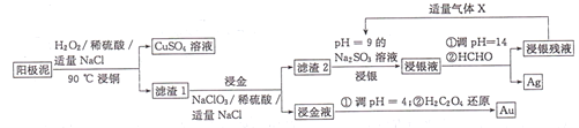
�ش��������⣺
��1������ͭ��ʱ��ͭ���뷴Ӧ�����ӷ���ʽΪ______________�����¶ȹ��ߣ�ͭ�Ľ����ʻή�ͣ�ԭ����______________��
��2��������Һ������Ҫ�ɷ���H[AuCl4]�����𡱲��跢����Ӧ�Ļ�ѧ����ʽΪNaCl+NaClO3+Au+H2SO4��Na2SO4+H2O+H[AuCl4](δ��ƽ�����÷�Ӧ���������뻹ԭ�����ʵ���֮��Ϊ______________,����ˮ��Ҳ���ܽ����ˮ�ijɷ�Ϊ______________��
��3���ӡ�����Һ������ȡ��ʱ�������ͻ�ԭ�������ʵ���֮��Ϊ______________��
��4����������ʱ������ӦAgCl+2SO32-![]() Ag(SO3)23-+C1-,Ag(SO3)23-��HCHO����ΪCO32-��������Һ����ͨ������X���ɵõ�Na2SO3����Һ��X�Ļ�ѧʽΪ______________��Na2SO3����Һ��ѭ��ʹ�ô��������Ľ����ʹ�ϵ��ͼ��ʾ��
Ag(SO3)23-+C1-,Ag(SO3)23-��HCHO����ΪCO32-��������Һ����ͨ������X���ɵõ�Na2SO3����Һ��X�Ļ�ѧʽΪ______________��Na2SO3����Һ��ѭ��ʹ�ô��������Ľ����ʹ�ϵ��ͼ��ʾ��

��ƽ���ƶ��ǶȽ����������ߵı仯ԭ��______________��
���𰸡�Cu+2H++H2O2=Cu2++2H2O �¶ȹ��ᵼ��H2O2�����ֽ� 1��2 1���Ũ�����3���Ũ���� 2 ��3 SO2 Na2SO3����Һ�к���Cl-.���ʹ��Na2SO3����Һ����۴���Cl-��c(Cl-)����ʹAgCl+2SO32-![]() Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ�
Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ�
��������
�������ͼ�е���Ϣ���ڽ�ͭ�����У�H2O2������������ͭ���ʣ�����1ΪAg��Au������2ΪAgCl��������Һ������Ҫ�ɷ���H[AuCl4]��AgCl��pH=9��Na2SO3��Һ��Ӧ����Ag(SO3)23-��Ag(SO3)23-��HCHO����������ԭ��Ӧ����Ag��H[AuCl4]��H2C2O4��ԭΪAu�������漰������ԭ��Ӧ����ʽ��ƽ���������뻹ԭ�������ʵ���֮�ȶ�����������ԭ��Ӧ�е�ʧ�����غ�ķ���ȥ����
��1���ڽ�ͭ�����У�H2O2������������ͭ������Һ�з�Ӧ�����ӷ���ʽΪCu+2H++H2O2=Cu2++2H2O�����¶ȹ��ߣ�H2O2���ȷֽ��������ʵ����ҪH2O2����ҪԶԶ��������Ҫ����������������ͭ�Ľ����ʻή�ͣ�
��2����Ӧ��ClԪ�ػ��ϼ���+5�۽���Ϊ-1�ۣ�NaClO3����������Au��0�����ߵ�+3�ۣ�Au����ԭ��������������ԭ��Ӧ�л��ϼ�����������ȣ��ʸ÷�Ӧ���������뻹ԭ�������ʵ���֮��Ϊ1��2������ˮ��Ҳ�����ܽ����ˮ�ijɷ�Ϊ1���Ũ�����3���Ũ���
��3������Һ����Ҫ�ɷ�Ϊ[AuCl4]-��[AuCl4]-��AuԪ�صĻ��ϼ�Ϊ+3�ۣ�1mol[AuCl4]-����ԭΪAu���õ�3mol���ӣ�[AuCl4]-�ڷ�Ӧ������������H2C2O4�ڷ�Ӧ��CԪ�صĻ��ϼ�Ϊ+3�ۣ�H2C2O4������ΪCO2��CO2��CԪ�صĻ��ϼ�Ϊ+4�ۣ�H2C2O4����ԭ������1molH2C2O4������Ϊ2molCO2ʧȥ2mol���ӣ�����������ԭ��Ӧ�е�ʧ�����غ㣬��������Һ������ȡ��ʱ�������ͻ�ԭ�������ʵ���֮��Ϊ2:3��
��4��Ϊ���ٷ�Һ���ŷţ����������Դ��������ҺpHԼΪ14��ͨ��SO2�õ�Na2SO3����Һ����������ʱ������ӦAgCl+2SO32-![]() Ag(SO3)23-+C1-���÷�ӦΪ���淴Ӧ��Na2SO3����Һ�к���Cl-�����ʹ��Na2SO3����Һ����۴���Cl-��c(Cl-)����ʹAgCl+2SO32-
Ag(SO3)23-+C1-���÷�ӦΪ���淴Ӧ��Na2SO3����Һ�к���Cl-�����ʹ��Na2SO3����Һ����۴���Cl-��c(Cl-)����ʹAgCl+2SO32-![]() Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ⣬�������Ľ������½���
Ag(SO3)23-+Cl-ƽ�������ƶ���������AgCl���ܽ⣬�������Ľ������½���

����Ŀ�������������ֽ�����ĩA��B�ֱ���ͬŨ�ȵ�����ϡ���ᷴӦ��������+2�۽����Ȼ���䷴Ӧ�����ͼ��ʾ��
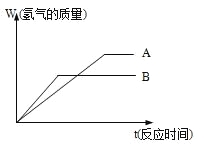
(1) ���ֽ����Ļ��˳����_____>______
���ֽ����Ȼ����Ħ��������_____>______
(2) �����ֽ�����ĩ��һ��������Ϻ��мס���
������ʵ�飬����ʵ���ȡ500mLͬŨ�ȵ�����
��Һ������ֻ�Ϸ�ĩ���������壬�й��������£�
ʵ����� | �� | �� | �� |
��Ϸ�ĩ����(g) | 6.2 | 18.6 | 24.8 |
������������(mL) | 2240 | 5600 | 5600 |
������ʵ���У�����________(��������������������������������)
���������õ���������ʵ���Ũ��Ϊ_____mol/L����Ϸ�ĩ��ƽ��Ħ��������________��