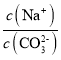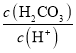题目内容
【题目】0.1 mol的镁、铝混合物溶于100 mL 2mol·L-1H2SO4溶液中,然后再滴加1 mol·L-1NaOH溶液。请回答:
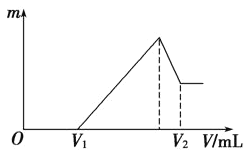
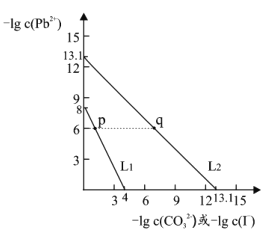
(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=120mL时,则金属粉末中n(Mg)=________,V2=________mL。
(2)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=________mL。
(3)若向300mL 1 mol/LAL2(SO4)3的溶液中逐渐加入浓度为1mol/L的![]() 溶液,若产生2.34克白色沉淀,则加入的NaOH溶液的体积可能为__________毫升。
溶液,若产生2.34克白色沉淀,则加入的NaOH溶液的体积可能为__________毫升。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol·L-1硫酸溶解此混合物后,再加入460 mL 1 mol·L-1NaOH溶液,所得沉淀中无Al(OH)3。满足条件的a的取值范围是________。
【答案】0.02 mol 480 400 90mL或2370 mL 0.4≤a <1
【解析】
(1)根据图象可知,在滴加NaOH溶液到体积V1=120mL过程中,没有沉淀生成,说明硫酸有剩余,滴加的NaOH用于中和剩余硫酸,V1=120mL时,剩余的H2SO4与滴加的NaOH恰好完全反应,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,设MgSO4为xmol,Al2(SO4)3为ymol,根据守恒列方程求算n(Mg);当滴加NaOH溶液到体积V2时,Al(OH)3完全溶解,沉淀是Mg(OH)2,溶液是Na2SO4和NaAlO2混合液.根据守恒有:![]() ,据此求出n(NaOH),再利用V=n/c计算;
,据此求出n(NaOH),再利用V=n/c计算;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,即沉淀达到最大值,此时,溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有![]() 求出n(NaOH),再利用V=n/c计算;
求出n(NaOH),再利用V=n/c计算;
(3)发生反应![]() ,
,![]() ,NaOH溶液可能少量只发生反应1,也可能量较多,反生反应1和反应2,根据沉淀质量计算;
,NaOH溶液可能少量只发生反应1,也可能量较多,反生反应1和反应2,根据沉淀质量计算;
(4)反应后的混合溶液,再加入460mL 1mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,由于为金属混合物,则a<1,根据钠离子守恒,应满足n(NaOH)≥2n(Na2SO4)+n(NaAlO2),根据铝元素守恒用x表示出n(NaAlO2),据此确定a的取值范围。
(1)100mL2mol/L的H2SO4溶液中硫酸的物质的量为:0.1L×2mol/L=0.2mol,
当V1=120mL时,此时,溶液是MgSO4、Al2(SO4)3和Na2SO4混合液,
由Na+离子守恒可知,n(Na2SO4)=0.5n(Na+)=0.5n(NaOH)=0.5×0.12L×1mol·L-1=0.06mol,
设MgSO4为xmol,Al2(SO4)3为ymol,则:
根据Mg原子、Al原子守恒有:x+2y=0.1
根据SO42-离子守恒有:x+3y=0.2-0.06=0.14,
联立解得:x=0.02;y=0.04,
所以金属粉末中n(Mg)=0.02mol,n(Al)=2y=2×0.04mol=0.08mol;
滴加NaOH溶液到体积V2时,溶液是Na2SO4和NaAlO2混合液,根据SO42-离子、Na+离子和Al原子守恒有:![]() ,所以
,所以![]() ,
,
故答案为:0.02;480;
(2)当溶液中Mg2+、Al3+恰好沉淀完全时,此时溶液是Na2SO4溶液,根据SO42-离子和Na+离子守恒有:![]() ,,所以
,,所以![]() ,
,
故答案为:400;
(3) 发生反应![]() ,
,![]() ,当NaOH量少时只发生反应1,
,当NaOH量少时只发生反应1, ![]() ,则NaOH体积
,则NaOH体积![]() 。当NaOH量多时,发生反应1和2,反应1中NaOH消耗物质的量为
。当NaOH量多时,发生反应1和2,反应1中NaOH消耗物质的量为![]() ,反应2中参加反应Al(OH)3物质的量为0.6mol-0.03mol=0.57mol,消耗NaOH物质的量
,反应2中参加反应Al(OH)3物质的量为0.6mol-0.03mol=0.57mol,消耗NaOH物质的量![]() ,故总消耗NaOH体积
,故总消耗NaOH体积![]() ,
,
故答案为:90mL或2370 mL;
(4)由于为金属混合物,则a<1,Al的物质的量为0.1(1-a)mol,反应后的混合溶液,再加入460mL1mol·L-1的NaOH溶液,所得沉淀中无Al(OH)3,溶质为硫酸钠、偏铝酸钠,根据铝元素守恒可知n(NaAlO2)=0.1(1-a)mol,根据钠离子守恒,应满足n(NaOH) ≥2n(Na2SO4)+n(NaAlO2),即0.46×1≥2×0.1×2+0.1(1-a),解得a≥0.4,故0.4≤a <1,
故答案为:0.4≤a <1。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案