题目内容
【题目】某研究小组向某2 L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)![]() D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
D(g)+E(g) ΔH=Q kJ·mol-1。在T℃时,反应进行到不同时间测得各物质的物质的量如表:
时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
(1)T℃时,该反应的平衡常数K=________。
(2)30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是________(填字母编号)。
a.通入一定量的B b.加入一定量的固体A c.适当缩小容器的体积 d.升高反应体系温度 e.同时加入0.2mol B、0.1mol D、0.1mol E
(3)写出下列电解质在水中的电离方程式:
CH3COOH:____________NaHSO4:______ NaHCO3:_________H2CO3:_________
【答案】0.25 ae CH3COOH![]() CH3COO-+H+ NaHSO4=Na++H++SO42- NaHCO3=Na++HCO3-,HCO3-
CH3COO-+H+ NaHSO4=Na++H++SO42- NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-; H2CO3
H++CO32-; H2CO3![]() H++ HCO3-,HCO3-
H++ HCO3-,HCO3-![]() H++CO32-
H++CO32-
【解析】
(1)由于该反应反应前后气体系数之和相等,所以计算平衡常数时,可以用物质的量代替物质的量浓度。T℃时,该反应的平衡常数K=![]() 。
。
(2)40min重新平衡时,平衡常数K=![]() ,平衡常数不变。
,平衡常数不变。
a.通入一定量的B,可以看做是增大压强,增加的B的转化率和原平衡相同,达到新平衡时B、D、E会按照原平衡时的比例增大,故a选;
b.加入一定量的固体A,平衡不移动,B、D、E的物质的量不会增加,故b不选;
c.适当缩小容器的体积,平衡不移动,B、D、E的物质的量不会增加,故c不选;
d.升高反应体系温度,会使平衡常数发生改变,故d不选;
e.同时加入0.2 mol B、0.1 mol D、0.1 mol E,是按照原平衡时的比例加入各物质,相当于增大压强,平衡不移动,但B、D、E会按照原平衡时的比例增大,故e选;
故选ae;
(3)醋酸是弱酸,电离是微弱的,其电离方程式为:CH3COOH![]() CH3COO-+H+;
CH3COO-+H+;
硫酸是强酸,所以NaHSO4在水中可以完全电离,其电离方程式为:NaHSO4=Na++H++SO42-;
碳酸是弱酸,所以NaHCO3在水中的电离要分步进行,其电离方程式为:NaHCO3=Na++HCO3-,HCO3-![]() H++CO32-;
H++CO32-;
碳酸是弱酸,分步电离,其电离方程式为:H2CO3![]() H++ HCO3-,HCO3-
H++ HCO3-,HCO3-![]() H++CO32-。
H++CO32-。

【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向X溶液中滴加 | X溶液中一定含有 |
B | 向浓度均为0.05mol·L-1的 |
|
C | 向2mL浓度均为0.05mol·L-1的 |
|
D | 向 | 结合 |
A.AB.BC.CD.D
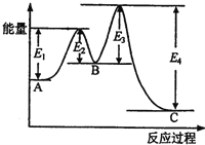
【题目】![]() 反应过程的能量变化如图所示,请回答下列问题:
反应过程的能量变化如图所示,请回答下列问题:

(1)该反应是______________(填“放热”或“吸热”)反应。
(2)用![]() 作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
作该反应的催化剂,A、C两点的能量差是否变化?_____________(填“变化”或“不变”),理由是____________________。
(3)在体积为2L的恒容密闭容器中通入2mol![]() 和3mol
和3mol![]() 发生上述反应,10min内
发生上述反应,10min内![]() 的物质的量变化如下表:
的物质的量变化如下表:
反应时间(min) | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
①升高温度,反应速率______________(填“增大”或“减小”)。
②上述反应在7min时_______________(填“达到”或“未达到”)平衡状态。
③![]() min内,用
min内,用![]() 表示该反应的反应速率为_______________mol·L-1·min-1。
表示该反应的反应速率为_______________mol·L-1·min-1。