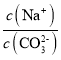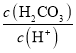��Ŀ����
����Ŀ���ۺ���������ˮ��������Ҫ�����������Ի����������![]() ��Ҫ�ɷ�ΪFe2O3��FeO��SiO2��
��Ҫ�ɷ�ΪFe2O3��FeO��SiO2��![]() Ϊԭ����ȡ�ۺ�������(Fe2(OH)x(SO4)(3-
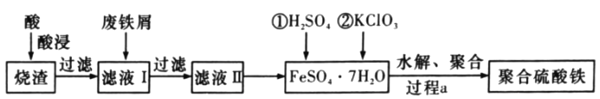
Ϊԭ����ȡ�ۺ�������(Fe2(OH)x(SO4)(3-![]() ))�Ĺ���������ͼ��ʾ��
))�Ĺ���������ͼ��ʾ��
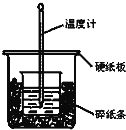
(1)�������ʱ����ʵ�����______![]() д��ѧʽ
д��ѧʽ![]() ��
��
(2)�����������Һ����Ҫ�Ľ�����������______��
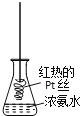
(3)����KClO3��Ŀ����______(������ӷ���ʽ˵��)��
(4)������a�������ɾۺ��������Ĺ�������ˮ���پۺϣ�������ˮ�ⷴӦԭ���Ļ�ѧ����ʽ����������Fe2(SO4)3+______H2O![]() ______Fe2(OH)x(SO4)(3-
______Fe2(OH)x(SO4)(3-![]() )+______��
)+______��
(5)�λ���B�Ǻ�������������Ч������Ҫָ�꣬ͨ���λ���Խ�ߣ�����Ч��Խ�á���֪�λ���B�ı���ʽΪB=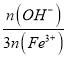 ��100%(nΪ���ʵ���
��100%(nΪ���ʵ���![]() ��Ϊ����ۺ����������λ��ȣ���������ʵ�������
��Ϊ����ۺ����������λ��ȣ���������ʵ�������
![]() ȡ�ۺ���������Ʒmg������������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���ټ���KF��Һ����Fe3+��ʹFe3+����OH-��Ӧ��Ȼ���Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺV0mL��
ȡ�ۺ���������Ʒmg������������ᣬ��ַ�Ӧ���ټ�����к���ȴ������ˮ���ټ���KF��Һ����Fe3+��ʹFe3+����OH-��Ӧ��Ȼ���Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺV0mL��
![]() ���հԱ�ʵ�飺ȡ�벽��i�������Ũ�ȵ����ᣬ�Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺVmL��
���հԱ�ʵ�飺ȡ�벽��i�������Ũ�ȵ����ᣬ�Է�̪Ϊָʾ������cmol/L�ı�NaOH��Һ�����к͵ζ������յ�ʱ����NaOH��ҺVmL��
�ٸþۺ���������Ʒ�У�n(OH-)=______mol��
����֪����Ʒ��Fe����������Ϊ![]() �����λ���B=______��
�������B=______��
���𰸡�H2SO4 Fe3+��Fe2+ ��Fe2+����ΪFe3+ ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O x 1 ![]() H2SO4 10-3cV0-10-3cV
H2SO4 10-3cV0-10-3cV ![]() ��100%
��100%
��������
�������������Ҫ�ɷ�ΪFe2O3��FeO��SiO2�ȣ��������м������ȡ�����Ʊ�Ŀ�Ŀ�֪���������Ϊϡ���ᣬFe2O3��FeO�ǽ����������ϡ���ᷴӦ�ֱ�õ�������������������SiO2��������������������ᣬ���˺�õ�����ҺI�к�������������������������ϡ���ᣬ����ҺI�м������м��Fe����������Ӧ�����������������˺�õ�����ҺII�к�����������������Һ����Ũ������ȴ�ᾧ�����˵õ��̷������̷��м���ϡ���ᡢ����أ�������Ӧ6H++ClO3-+6Fe2+=6Fe3++Cl-+3H2O��Ȼ����ˮ�⡢�ۺϷ�ӦFe2(SO4)3+xH2O![]() Fe2(OH)x(SO4)(3-
Fe2(OH)x(SO4)(3-![]() )+
)+![]() H2SO4���Դ˽����⡣
H2SO4���Դ˽����⡣
(1)ͨ�����Ϸ���֪���������ΪH2SO4��
(2)��������Һ�к�������������������������ϡ���ᣬ���Ժ��е���������Fe3+��Fe2+��H+�����еĽ���������ΪFe3+��Fe2+��
(3)����ؾ���ǿ�����ԣ������������������������Ӷ���ȡ�ۺ����������ص������ǽ�Fe2+����ΪFe3+���漰�ķ���ʽΪ6H++ClO3-+6Fe2+=6Fe3++Cl-+3H2O��
(4)����Ԫ���غ㣬�÷�Ӧ����ʽΪFe2(SO4)3+xH2O![]() Fe2(OH)x(SO4)(3-
Fe2(OH)x(SO4)(3-![]() )+
)+![]() H2SO4���ʿ���ֱ���x��1��
H2SO4���ʿ���ֱ���x��1��![]() H2SO4��
H2SO4��
(5)��n(OH-)=cmol/L��10-3V0L-cmol/L��10-3VL=10-3c(V0-V)mol��
�ڸ���Ʒ��Fe����������w����n(Fe)=![]() mol���λ���B=
mol�����B= ��100%=
��100%=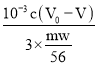 ��100%=
��100%=![]() ��100%��
��100%��

 �Ķ��쳵ϵ�д�
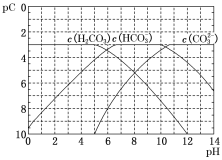
�Ķ��쳵ϵ�д�����Ŀ��![]() ��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺
��Ӧ���̵������仯��ͼ��ʾ����ش��������⣺
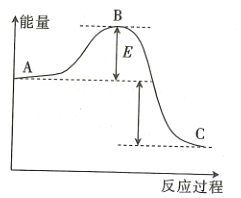
(1)�÷�Ӧ��______________��������������������������Ӧ��
(2)��![]() ���÷�Ӧ�Ĵ�����A��C������������Ƿ�仯?_____________�������仯����������������������____________________��
���÷�Ӧ�Ĵ�����A��C������������Ƿ�仯?_____________�������仯����������������������____________________��
(3)�����Ϊ2L�ĺ����ܱ�������ͨ��2mol![]() ��3mol
��3mol![]() ����������Ӧ��10min��
����������Ӧ��10min��![]() �����ʵ����仯���±���
�����ʵ����仯���±���
��Ӧʱ�䣨min�� | 0 | 3 | 5 | 7 | 10 |
| 0 | 0.2 | 0.3 | 0.38 | 0.38 |
�������¶ȣ���Ӧ����______________������������������С������
��������Ӧ��7minʱ_______________�������ﵽ������δ�ﵽ����ƽ��״̬��
��![]() min�ڣ���
min�ڣ���![]() ��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ_______________mol��L-1��min-1��
��ʾ�÷�Ӧ�ķ�Ӧ����Ϊ_______________mol��L-1��min-1��