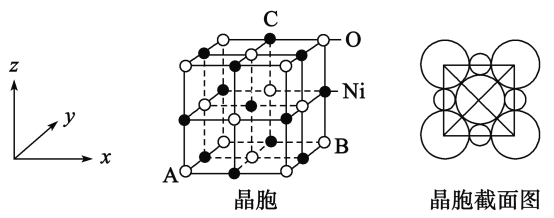
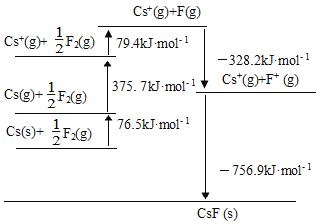
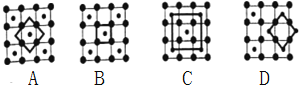
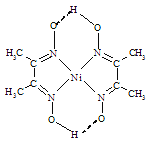
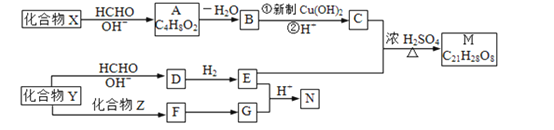
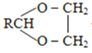
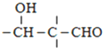题目内容
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
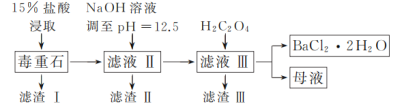
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
【答案】既加快反应速度又提高浸取率 SiO2、BaSO4 防止生成BaC2O4 ABD 除去表面附着的Ba2+,防止污染环境 灼烧碳酸钡石至恒重,用80℃热水溶解固体,趁热过滤,向滤液中加入稍过量的6mol·L-1盐酸,蒸发浓缩,冷却结晶
【解析】
毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)加入盐酸溶解,生成氯化钙、氯化镁、氯化钡和氯化铁,且少量硫酸根离子与钡离子反应生成硫酸钡,滤渣Ⅰ为SiO2、BaSO4;加入氢氧化钠溶液调至pH=12.5,铁离子、镁离子转化为氢氧化镁、氢氧化铁沉淀进入滤渣Ⅱ,滤液为氯化钡、氯化钙、氯化钠和氢氧化钠,加入草酸反应生成草酸钙沉淀,即滤渣Ⅲ为草酸钙;滤液Ⅲ蒸发浓缩、冷却结晶得到氯化钡晶体。据此分析解答。
(1)盐酸浸取时,适当加热,可以加快反应速度,提高浸取率,故答案为:既加快反应速度又提高浸取率;
(2)酸溶时,SiO2不溶于盐酸和水,且溶液中的SO42-和Ba2+反应生成BaSO4沉淀,则过滤所得滤渣Ⅰ的成分为SiO2、BaSO4,故答案为:SiO2、BaSO4;
(3)加入H2C2O4的目的是除去溶液中的Ca2+,但草酸过量时,也会生成BaC2O4沉淀,故答案为:防止生成BaC2O4;
(4)用37%的盐酸配制15%的盐酸,需要用量筒量取适量的37%的盐酸倒入烧杯中,然后向烧杯中加入一定量的蒸馏水,用玻璃棒搅拌均匀即可,需用到的仪器有量筒、烧杯、玻璃棒,故答案为:ABD;
(5)滤渣Ⅲ为草酸钙,溶液中的氯化钡吸附在草酸钙的表面,钡离子属于重金属离子,会污染环境,因此需经过洗涤后才能进行后续加工处理,故答案为:除去表面附着的Ba2+,防止污染环境;
(6)用碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O,根据题给试剂,可以首先将碳酸钡石粉碎煅烧,使碳酸钡石分解,因为氢氧化钙的溶解度较小,且温度越高,溶解度越小,然后用80℃热水溶解固体,趁热过滤,除去氢氧化钙,将生成的氢氧化钡用6mol·L-1盐酸中和,得到氯化钡溶液,蒸发浓缩,冷却结晶得到BaCl2·2H2O粗品,过滤,用无水乙醇洗涤2~3次,低温干燥即可,故答案为:灼烧碳酸钡石至恒重,用80℃热水溶解固体,趁热过滤,向滤液中加入稍过量的6mol·L-1盐酸,蒸发浓缩,冷却结晶。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案