题目内容
【题目】常温下,向10mL0.1 mol/L CuCl2溶液中滴加0.1 mol/L Na2S溶液滴加过程中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )

A. 该温度下Ksp(CuS)=10-35.4
B. 曲线上各点的溶液均满足关系式c(S2-)·c(Cu2+)=Ksp(CuS)
C. Na2S溶液中C(S2-)+C(HS-)+C(H2S)=2C(Na+)
D. c点溶液中:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+)
【答案】C
【解析】
向10mL0.1mol/LCuCl2溶液中滴加0.1mol/L的Na2S溶液,发生反应:Cu2++S2-![]() CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
CuS↓,Cu2+单独存在或S2-单独存在均会水解,水解促进水的电离,结合图象计算溶度积常数和溶液中的守恒思想,据此判断分析。
A.b点是CuCl2溶液与Na2S溶液恰好完全的点,该温度下,平衡时c(Cu2+)=c(S2-)=10-17.7mol/L,则Ksp(CuS)=c(Cu2+)c(S2-)=10-17.7mol/L×10-17.7mol/L=10-35.4mol2/L2,故A正确;
B.向含有Cu2+的溶液中加入Na2S溶液,Cu2+与S2-发生沉淀反应:Cu2++S2-![]() CuS↓,加入Na2S溶液的体积越大,c(S2-)越大,c(Cu2+)越小,则-lg c(Cu2+)就越大,由于温度不变,所以曲线上各点的溶液均满足关系式:c(S2-)·c(Cu2+)=Ksp(CuS),故B正确;
CuS↓,加入Na2S溶液的体积越大,c(S2-)越大,c(Cu2+)越小,则-lg c(Cu2+)就越大,由于温度不变,所以曲线上各点的溶液均满足关系式:c(S2-)·c(Cu2+)=Ksp(CuS),故B正确;
C.Na2S溶液中,根据物料守恒,2c(S2-)+2c(HS-)+2c(H2S)═c(Na+),故C错误;
D.c点为Na2S、NaCl按1:2物质的量混合溶液,其中CuS处于沉淀溶解平衡状态,根据物料守恒及物质的溶解性可知:c(Na+)>c(Cl-)>c(S2-),S2-水解消耗水电离产生H+,使溶液中c(OH-)>c(H+),但水电离产生的离子浓度远小于盐电离产生的离子浓度,故c(S2-)>c(OH-),因此该溶液中微粒浓度大小关系为:c(Na+)>c(Cl-)>c(S2-)>c(OH-)>c(H+),故D正确。
故选C。

【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
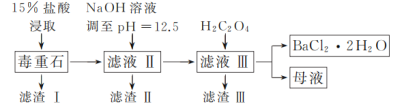
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
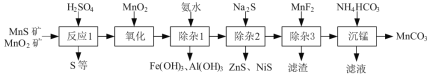
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。