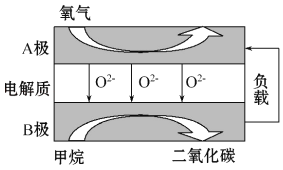
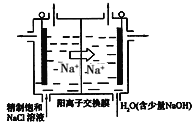
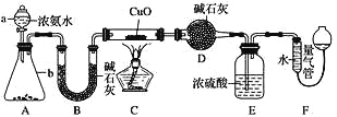
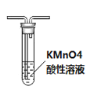
题目内容
【题目】CsF是离子晶体,其晶格能可通过下图的循环计算得到,以下说法错误的是
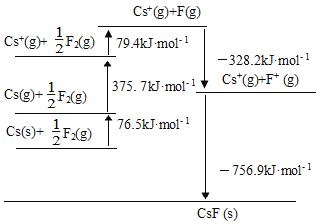
A. Cs原子的第一电离能为452.2 kJ·mol1
B. F-F键的键能为158.8 kJ·mol1
C. CsF的晶格能756.9kJ·mol1
D. 1molCs(s)转变成Cs(g)所要吸收的能量为76.5kJ
【答案】A
【解析】
A.由图示知, Cs原子的第一电离能是由气态原子失去1个电子形成气态离子所需要的能量,应为375.7.2 kJ·mol1,故A错误;
B. 由图示知,F-F键的键能为由1molF2分解为2mol F所吸收的能量,即79.4 kJ·mol1×2=158.8 kJ·mol1,故B正确;
C. CsF的晶格能是指拆开1mol离子晶体使之形成气态阴离子和气态阳离子时所吸收的能量,即756.9kJ·mol1,故C正确;
D.由图示知, 1molCs(s)转变成Cs(g)所要吸收的能量为76.5kJ,故D正确,
故选A。

 阅读快车系列答案
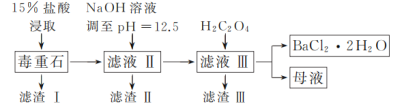
阅读快车系列答案【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)