题目内容
【题目】镍是有机合成的重要催化剂。
(1)基态镍原子的价电子排布式___________________________
(2)镍和苯基硼酸共催化剂实现了丙烯醇(CH2=CH—CH2OH)的绿色高效合成.丙烯醇中碳原子的杂化类型有______________________;丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,其主要原因是________________________。
(3)羰基镍[Ni(CO)4]用于制备高纯度镍粉.羰基镍[Ni(CO)4]中Ni、C、O 的电负性由大到小的顺序为______。
(4)Ni2+ 能形成多种配离子,如[Ni(NH3)6]2+、[Ni(SCN)3]- 等。NH3 的空间构型为:_______;与SCN- 互为等电子体的分子有:__________________(填分子式)
(5)“NiO”晶胞如图:
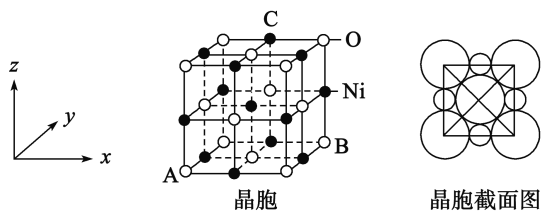
①氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为_____________
②已知氧化镍晶胞密度dg/cm3,NA 代表阿伏加德罗常数的值,则Ni2+ 半径为________nm(用代数式表示)
【答案】3d84s2 sp2、sp3 丙烯醇中分子间存在氢键 O>C>Ni 三角锥形 N2O或CO2 ![]()
![]()
【解析】
根据晶胞参数相关信息计算分析解答;根据杂化轨道理论分析解答。
(1)Ni是28号元素,它的基态原子核外电子排布式为:[Ar] 3d84s2,则它的价电子排布式为:3d84s2,
故答案为:3d84s2;
(2) 丙烯醇中碳原子形成了一个碳碳双键,其余为碳氧、碳氢单键,所以C原子的杂化类型有sp2和sp3杂化,丙醛(CH3CH2CHO)与丙烯醇(CH2=CH—CH2OH)分子量相等,但丙醛比丙烯醇的沸点低的多,是因为丙烯醇分子间存在氢键,
故答案为:sp2、sp3;丙烯醇中分子间存在氢键;
(3)同周期元素,从左到右电负性逐渐增强,同族元素,从上到下电负性逐渐减弱,则电负性:O>C>Ni,
故答案为:O>C>Ni;
(4) NH3分子中N原子是sp3杂化,且具有一对孤对电子,则NH3的空间构型为三角锥形,与SCN- 互为等电子体的分子有: N2O或CO2,
故答案为:三角锥形,N2O或CO2;
(5)①晶胞是正方体结构,且氧化镍晶胞中原子坐标参数A为(0,0,0),B为(1,1,0),则C原子坐标参数为(![]() ,1,1),
,1,1),
故答案为:(![]() ,1,1);
,1,1);
②已知氧化镍晶胞密度dg/cm3,设Ni2+ 半径为rnm,O原子半径为xnm,晶胞的参数为anm,一个晶胞中含有4个NiO,则m(晶胞)= ![]() g,V(晶胞)=a3,则可以得到(a×107)3·d=
g,V(晶胞)=a3,则可以得到(a×107)3·d=![]() ,a=
,a=![]() ×107nm,又因为晶胞对角线3个O原子相切,晶胞参数a=2x+2r,即4x=
×107nm,又因为晶胞对角线3个O原子相切,晶胞参数a=2x+2r,即4x=![]() a,x=
a,x=![]() a,带入计算可得到r=
a,带入计算可得到r=![]() =
=![]() ×
×![]() ×107nm,
×107nm,
故答案为:![]() ×
×![]() ×107nm。
×107nm。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)