题目内容
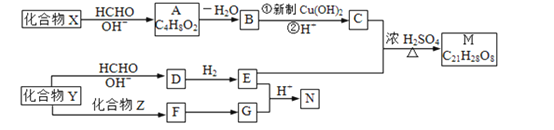
【题目】重要的精细化学品M和N,常用作交联剂、涂料、杀虫剂等,合成路线如图1所示:
图1:
已知:i、-CHO+![]()
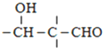
ii、RCHO+![]()
![]()
 +H2O
+H2O
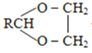
iii、N的结构简式是
请回答下列问题:
(1)A中含氧官能团名称是______________,由A生成B的反应类型是___________。
(2)写出下列物质的结构简式:X:_________Z:______________E:______
(3)C和甲醇反应的产物可以聚合形成有机玻璃,该聚合反应的化学方程式是:____。
(4)G中碳原子________(填“一定”、“不一定”或“一定不”)在同一平面内;1mol G一定条件下,最多能与________mol H2发生反应;与G含有相同官能团的同分异构体(不包含G)有___________种。
(5)由Y生成D的化学方程式是________________________________。
【答案】羟基、醛基 消去反应 CH3CH2CHO ![]()
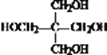
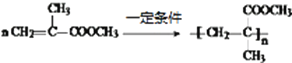 不一定 5 4 CH3CHO+3HCHO
不一定 5 4 CH3CHO+3HCHO![]()
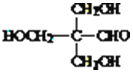
【解析】
由有机物转化关系结合分子式可知,有机物CH3CH2CHO与HCHO发生已知i反应生成HOCH2CH(CH3)CHO,则X为CH3CH2CHO、A为HOCH2CH(CH3)CHO;HOCH2CH(CH3)CHO发生消去反应生成CH2═C(CH3)CHO,则B为CH2═C(CH3)CHO;CH2═C(CH3)CHO与新制氢氧化铜发生氧化反应,酸化生成CH2═C(CH3)COOH,则C为CH2═C(CH3)COOH;由N的结构简式为![]() ,结合已知ii中反应可知,E、G分别为
,结合已知ii中反应可知,E、G分别为![]() 、
、![]() 中的一种,C与E反应可以合成M,结合M的分子式C21H28O8可知,E为
中的一种,C与E反应可以合成M,结合M的分子式C21H28O8可知,E为![]() ,则G为
,则G为![]() ;C与E通过酯化反应生成M,由Y到E的转化,结合E的结构可知,Y不含苯环,再结合G的结构可知,化合物Z中含有苯环,结合反应已知i可知,Y为CH3CHO,Z为
;C与E通过酯化反应生成M,由Y到E的转化,结合E的结构可知,Y不含苯环,再结合G的结构可知,化合物Z中含有苯环,结合反应已知i可知,Y为CH3CHO,Z为![]() ,故F为
,故F为![]() ;由E的结构可知,1分子CH3CHO与3分子HCHO发生已知i反应生成D,D为
;由E的结构可知,1分子CH3CHO与3分子HCHO发生已知i反应生成D,D为![]() ,D与氢气发生加成反应生成E(
,D与氢气发生加成反应生成E(![]() )。
)。
(1)A的结构简式为HOCH2CH(CH3)CHO,含有的含氧官能团为羟基、醛基,故答案为:羟基、醛基;A→B是HOCH2CH(CH3)CHO发生消去反应脱去1分子H2O生成CH2═C(CH3)CHO,故答案为:消去反应;
(2)根据上述分析X的结构简式为CH3CH2CHO,Z的结构简式为![]() ,E的结构简式为
,E的结构简式为![]() ;故答案为:CH3CH2CHO,
;故答案为:CH3CH2CHO,![]() ,
,![]()
(3)C的结构简式为CH2═C(CH3)COOH,CH2═C(CH3)COOH和甲醇发生酯化反应生成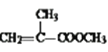 ,
,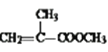 一定条件发生加聚反应生成
一定条件发生加聚反应生成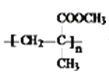 ,加聚反应的化学方程式为
,加聚反应的化学方程式为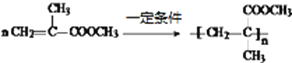 ,故答案为:
,故答案为:
 ;
;
(4)G的结构简式为![]() ,苯环、碳碳双键和醛基均为共面结构,但是由于单键可以旋转,如
,苯环、碳碳双键和醛基均为共面结构,但是由于单键可以旋转,如![]() 的结构*处,分子中碳原子不一定共平面;
的结构*处,分子中碳原子不一定共平面;![]() 分子中苯环、碳碳双键和醛基均能与氢气发生加成反应,一定条件下,1mol
分子中苯环、碳碳双键和醛基均能与氢气发生加成反应,一定条件下,1mol ![]() 最多能与5mol H2发生反应;G中的官能团为碳碳双键和醛基,与G含有相同官能团的同分异构体(不包含G)有:当苯环上只有1个侧链,侧链为—C(CHO)=CH2,只有1种结构,当苯环上有两个侧链,两个侧链为—CHO和—CH=CH2,两个侧链有邻、间、对3种位置,共3种,所以共有4种结构,故答案为:不一定;5;4;
最多能与5mol H2发生反应;G中的官能团为碳碳双键和醛基,与G含有相同官能团的同分异构体(不包含G)有:当苯环上只有1个侧链,侧链为—C(CHO)=CH2,只有1种结构,当苯环上有两个侧链,两个侧链为—CHO和—CH=CH2,两个侧链有邻、间、对3种位置,共3种,所以共有4种结构,故答案为:不一定;5;4;
(5)Y生成D的反应为1分子CH3CHO与3分子HCHO发生已知i反应生成![]() ,反应的化学方程式为
,反应的化学方程式为![]() ,故答案为:
,故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
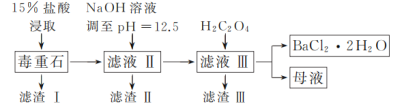
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0
【题目】(一种由天然MnO2矿与MnS矿(还含Fe、Al、Mg、Zn、Ni、Si等元素的氧化物)制备高纯碳酸锰工艺如下:
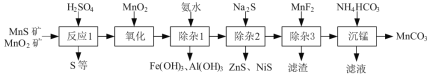
已知:相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
⑴“反应1”中MnO2与MnS反应的化学方程式为______。
⑵“反应1”后所得沉淀物中除S外,一定还含有的氧化物是______(填化学式)。
⑶“除杂2”后溶液中c(Zn2+)=1×105 mol·L1,则溶液中c(Ni2+)=______mol·L1。[已知:Ksp(ZnS)=2×1022,Ksp(NiS)=1×1024]
⑷“滤渣”的成分为______(填化学式);“滤液”中所含溶质的主要成分为___(填化学式)。
⑸将部分MnCO3溶于稀硫酸,所得溶液电解可制得MnO2循环使用。写出电解时所发生反应的离子方程式:______。