题目内容
【题目】过渡元素形成的化合物在生产中有重要的用途,请根据信息回答下列问题:
(1)某金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于____(填“晶体”或“非晶体”)。
(2)黄铜是最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)___Ⅰ1(Cu)(填“>”或“<”) ,原因是____。
(3)筑波材料科学国家实验室一个科研小组发现了在5K下呈现超导性的晶体CoO2,该晶体具有层状结构(如图所示,小球表示Co原子,大球表示O原子),图中用粗线画出的重复结构单元示意图,其中不能描述CoO2的化学组成的是____(填字母)。
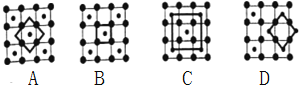
(4)在稀氨水中,丁二酮肟(CH3C=N-OH)2与Ni2+反应可生成鲜红色沉淀丁二酮肟镍(结构如图)和H+,常用于检验Ni2+。在丁二酮肟镍中,不存在的作用力有____。
A 配位键 B 离子键 C σ键 D π键 E 金属键 F 氢键
(5)Co3+ 的一种配离子[Co(N3) (NH3)5]2+中,配体有_____,1mol该配离子中所含σ键的数目______。
(6)某蓝色晶体中,Fe2+、Fe3+分别占据立方体互不相邻的顶点,而立方体的每条棱上均有一个CN-,K+位于立方体的某恰当位置上。据此可知该晶体的化学式为____,该立方体中Fe2+间连接起来形成的空间构型是______。
【答案】晶体 > Zn核外电子排布为全满稳定结构,较难失电子 B BE N3-、NH3 23NA KFe2(CN)6 正四面体
【解析】
根据晶体结构特征及概念判断物质是否为晶体;根据图示结构分析物质的组成及空间构型;根据化学键的定义分析化学键的类型及数目。
(1)根据晶体的特征,该金属原子在三维空间里呈周期性有序排列,所以该金属互化物属于晶体;
(2)Zn核外电子排布为全满稳定结构,较难失电子,所以其第一电离能大于Cu;
(3)A.根据图示,属于该重复单元的O原子数目为4×1/2=2,Co原子数为1,能描述CoO2的化学组成;
B.根据图示,属于该重复单元的O原子数目为4×1/4=1,Co原子数为1,不能描述CoO2的化学组成;
C.根据图示,属于该重复单元的O原子数目为4,Co原子数为4×1/4+1=2,能描述CoO2的化学组成;
D.根据图示,属于该重复单元的O原子数目为4×1/2=2,Co原子数为2×1/2=1,能描述CoO2的化学组成,故选B;
(4)根据结构式知,结构中的OH为氢键;NiN为配位键;单键为σ键;N=C中有π键;故不存在的作用力有金属键和离子键,故答案为BD;
(5)根据配离子[Co(N3) (NH3)5]2+的结构知,配体有N3-、NH3;每个NH3分子中有3个σ键,每个N3-中含有2个σ键,一个配位键是一个σ键,所以一个配离子中σ键数目为:3×5+1+2+5=23,则1mol该配离子中所含σ键的数目为23NA;
(6)根据题干信息知,晶胞中Fe2+、Fe3+数目一样多,其数目均为4×1/8=1/2,CN-的数目为12×1/4=3,根据电荷守恒可知,该晶体的化学式为KFe2(CN)6;Fe2+分别占据立方体互不相邻的顶点,则该立方体中Fe2+间连接起来形成的空间构型是正四面体,故答案为:KFe2(CN)6;正四面体。

【题目】下表是元素周期表的一部分,X、Y、Z、W为短周期主族元素,W的原子序数是Z的2倍。下列说法中正确的是
X | Y | Z | ||
W |
A.简单离子半径:Y<Z
B.Y元素的最高价氧化物对应的水化物在一定条件下可以和X单质反应
C.氢化物的沸点:X<Z
D.WZ2具有漂白性,其漂白原理与双氧水相同
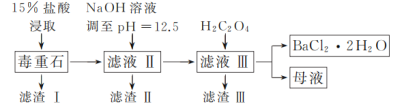
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
【题目】已知:2Cl2(g)+NH3(g)![]() NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
NHCl2(g)+2HCl(g)。向容积均为2 L的甲、乙恒温容器中分别加入含 Cl2和NH3各2 mol的混合物,测得容器中n(Cl2)随反应时间t变化情况如下表。下列说法正确的是( )
t/min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(甲,400℃)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(乙,T℃)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
A. T<400B. 反应在0~40min内,Q>K
C. 120min时,甲乙容器中NH3的ν(正)相等D. 反应的△H<0