题目内容
20.下表为元素周期表的-部分,请参照元素①一⑨在表中的位置,回答下列问题.
(1)第三周期中元素非金属性最强的元素的原子结构示意图是
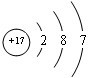 .
.(2)②③⑦最高价氧化物对应水化物酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3(填化学式).
(3)用电子式表示⑨的氢化物:
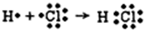 .
.(4)下列可以判断⑤和⑥金属性强弱的是cd(填序号).
a.单质的熔点⑤比⑥低 b.化合价⑤比⑥低
c.单质与水反应⑤比⑥剧烈 d.最高价氧化物的水化物的碱性⑤比⑥强
(5)含有上述元素的物质间存在以下转化:
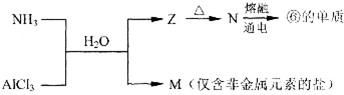
a.Z的化学式是Al(OH)3.
b.N生成⑥的单质反应的化学方程式是2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
分析 由元素在周期表中的位置可知知,①一⑨元素分别是H、C、N、O、Na、Al、Si、S、Cl元素,
(1)第三周期中元素非金属性最强的元素是Cl元素,Cl原子核外有3个电子层,三个电子层上的电子数分别是2、8、7;
(2)元素的非金属性越强,其最高价氧化物对应水化物酸性越强;
(3)⑨的氢化物是HCl,H原子和Cl原子通过共用电子对形成HCl分子;
(4)金属的金属性强弱判断方法有:金属与水或酸反应速率快慢、金属的最高价氧化物的水化物碱性强弱、金属之间的置换反应等;
(5)氨水和AlCl3溶液发生反应3NH3.H2O+AlCl3=Al(OH)3↓+3NH4Cl,Z加热生成N,N电解得到Al,则Z是Al(OH)3、N是Al2O3,M是NH4Cl.
解答 解:由元素在周期表中的位置知,①一⑨元素分别是H、C、N、O、Na、Al、Si、S、Cl元素,
(1)第三周期中元素非金属性最强的元素是Cl元素,Cl原子核外有3个电子层,三个电子层上的电子数分别是2、8、7,其原子结构示意图为 ,
,
故答案为: ;
;
(2)非金属性N>C>Si,所以酸性HNO3>H2CO3>H2SiO3,故答案为:HNO3>H2CO3>H2SiO3;
(3)⑨的氢化物是HCl,H原子和Cl原子通过共用电子对形成HCl分子,其形成过程为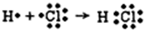 ,故答案为:
,故答案为: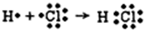 ;
;
(4)金属的金属性越强,金属与水或酸反应速率越快、金属的最高价氧化物的水化物碱性越强,金属的金属性强弱与元素化合价、单质的熔点无关,故选cd;
(5)氨水和AlCl3溶液发生反应3NH3.H2O+AlCl3=Al(OH)3↓+3NH4Cl,Z加热生成N,N电解得到Al,则Z是Al(OH)3、N是Al2O3,M是NH4Cl,
a.Z的化学式是NH4Cl,故答案为:Al(OH)3;
b.N生成⑥的单质反应的化学方程式为2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑,故答案为:2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、元素周期律及元素化合物知识为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.

| A. | 用湿润的pH试纸测稀溶液的pH,测定值可能偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小 |
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达到平衡后,NO的反应速率保持恒定 | |
| C. | 使用高效催化剂只能提高正反应速率,对逆反应速率无影响 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
| A. | 可溶于水 | B. | 具有较高的熔点 | C. | 水溶液能导电 | D. | 熔融状态能导电 |
①单位时间内断裂n mol H-H键的同时形成2n mol H-I键
②单位时间内生成n molI2的同时生成2n molHI
③2v正(H2)=v逆(HI)
④HI分子数不再改变
⑤混合气体颜色不再改变
⑥混合气体压强不再改变.
| A. | ②④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | 全部 |
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg Al | 稀盐酸 | 偏向Al |
| ② | Al Cu | 稀盐酸 | 偏向Cu |
| ③ | Al 石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al Cu | 浓硝酸 | 偏向Al |
(1)实验①、②的Al所作的电极分别是d(填序号)
a.负极,负极 b.正极,正极
c.负极,正极 d.正极,负极
(2)写出实验③中的电极反应式:铝电极:2Al-6e-═2Al3+,石墨电极:6H++6e-═3H2↑.
(3)对比实验①和②,以及①和④中的电流计指针偏转方向,总结在原电池中电极作正极还是负极受哪些因素影响两个电极的相对活泼性;电解质溶液的酸碱性
(4)解释实验⑤中,电流计指针偏向铝的原因Al钝化作正极,铜易失电子作负极,所以电流计指针偏向铝.
