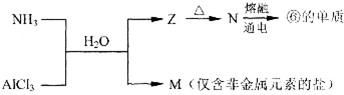
题目内容
15.(1)已知:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H1;2CH3OH(g)+3O2(g)═2CO2(g)+4H2O(g)△H2,则△H1>△H2
(2)在298K、100kPa时,已知:
2H2(g)+O2(g)═2H2O(g)△H1
2HCl(g)═Cl2(g)+H2(g)△H2
4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H3
则△H3与△H1和△H2的关系是:△H3=△H1+2△H2
(3)消除氮氧化物的污染对环境至关重要,用CH4催化还原NOx可以消除氮氧化物的污染.已知一定条件下:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
则该条件下,用CH4还原NO2至N2的热化学方程式为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol
(4)乙烯是石油裂解气的主要成分之一,25℃、101kPa时,1g乙烯燃烧生成CO2气体与液态水,放出50.5kJ的热量,该反应的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1414KJ/mol;利用该反应设计为燃料电池中,通入乙烯的电极为电池的负极(填“正极”或“负极”).
分析 (1)甲醇的燃烧是放热反应,而对于放热反应,反应物的能量越高,反应放出的热量越高;
(2)一个反应无论是一步完成还是分为几步完成,其热效应是相同的,据此分析;
(3)根据盖斯定律来书写热化学方程式;
(4)25℃、101kPa时,1g乙烯完全燃烧生成CO2气体与液态水,放出50.5kJ的热量,则1molC2H4完全燃烧放出50.5×28=-1414kJ的热量;在燃料电池中,可燃性物质发生氧化反应.
解答 解:(1)甲醇的燃烧是放热反应,而对于放热反应,反应物的能量越高,反应放出的热量越高.等物质的量的CH3OH(l)的能量低于CH3OH(g),故2molCH3OH(l)燃烧时放出的热量低于2molCH3OH(g)燃烧放出的热量,而放热反应的△H小于0,故△H1>△H2,故答案为:>;
(2)一个反应无论是一步完成还是分为几步完成,其热效应是相同的,已知反应:
2H2(g)+O2(g)═2H2O(g)△H1 ①
2HCl(g)═Cl2(g)+H2(g)△H2 ②
4HCl(g)+O2(g)═2Cl2(g)+2H2O(g)△H3 ③
将①+②×2=③,故反应热△H3=△H1+2△H2,故答案为:△H1+2△H2;
(3)①CH4(g)+4NO2(g)→4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)→2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ•mol-1
根据盖斯定律(①+②)×12,得:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol,故答案为:CH4(g)+2NO2(g)=CO2(g)+N2(g)△H=-867kJ/mol;
(4)甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数,则甲为C2H4,25℃、101kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5kJ的热量,则1molC2H4完全燃烧放出50.5×28=-1414kJ的热量,则乙烯燃烧的热化学方程式为C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1414KJ/mol;该反应设计的燃料电池中,可燃性物质乙烯发生氧化反应,在负极放电,
故答案为:C2H4(g)+3O2(g)=2CO2(g)+2H2O(l)△H=-1414KJ/mol;负极.
点评 本题考查盖斯定律的应用、热化学方程式的书写,为高频考点,综合性较强,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 改变温度,产物中KClO3的最大理论产量为17amol | |
| B. | 若某温度下,反应后c(Cl−)c(ClO−)=11,则溶液中c(ClO−)c(ClO−3)=12 | |
| C. | 参加反应的氯气的物质的量等于12amol | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:12amol≤ne≤amol |
| A. | NH5由分子构成 | B. | NH5属于离子化合物 | ||
| C. | NH5中N的化合价为-5价 | D. | NH5与水的反应是非氧化还原反应 |
| 元素代号 | L | M | Q | R | T |
| 原子半径/mm | 0.160 | 0.089 | 0.143 | 0.102 | 0.074 |
| 化合价 | +2 | +2 | +3 | +6,-2 | -2 |
| A. | L、M的单质与稀盐酸反应速率L<M | |
| B. | Q、T两元素间可形成两性化合物 | |
| C. | R、T两元素的氢化物分子间能形成氢键 | |
| D. | L、R两元素的简单离子的核外电子数可能相等 |
| A. | 达到化学平衡时,N2、H2和NH3的物质的量之比为1:3:2 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化 | |
| C. | 达到化学平衡时,N2不能完全转化为NH3 | |
| D. | 达到化学平衡时,容器中气体的总压强不再发生变化 |
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
| 实验步骤 | 实验操作 | 预期现象及结论 |
| 1 | 取少量所得溶液于试管中, 再滴入几滴稀盐酸 | 若无气泡产生,证明原溶液中不含有Na2CO3 |
| 2 | 另取少量所得溶液于试管中, 再滴入几滴Na2CO3溶液 | 若无沉淀产生,结合步骤1,猜想一成立. |

 .
.

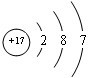 .
.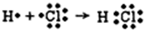 .
.