题目内容
4.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| ① | Mg Al | 稀盐酸 | 偏向Al |
| ② | Al Cu | 稀盐酸 | 偏向Cu |
| ③ | Al 石墨 | 稀盐酸 | 偏向石墨 |
| ④ | Mg Al | NaOH溶液 | 偏向Mg |
| ⑤ | Al Cu | 浓硝酸 | 偏向Al |
(1)实验①、②的Al所作的电极分别是d(填序号)
a.负极,负极 b.正极,正极
c.负极,正极 d.正极,负极
(2)写出实验③中的电极反应式:铝电极:2Al-6e-═2Al3+,石墨电极:6H++6e-═3H2↑.
(3)对比实验①和②,以及①和④中的电流计指针偏转方向,总结在原电池中电极作正极还是负极受哪些因素影响两个电极的相对活泼性;电解质溶液的酸碱性
(4)解释实验⑤中,电流计指针偏向铝的原因Al钝化作正极,铜易失电子作负极,所以电流计指针偏向铝.
分析 (1)金属与酸构成的原电池中,活泼金属作负极,据此对实验①、②进行判断;
(2)实验③中Al为负极,石墨为正极,电池反应为2Al+6HCl═2AlCl3+3H2↑;
(3)根据实验①、②2可知,原电池的正负极取决于金属的活泼性强弱;根据实验④可知,原电池的正负极与电解质溶液的酸碱性有关;
(4)实验5中Al遇浓硝酸发生钝化,发生Cu与浓硝酸的氧化还原反应,Cu作负极,Al作正极,所以电流计指针偏向铝.
解答 解:(1)金属与酸构成的原电池中,活泼金属作负极,则实验①中Mg的活泼性大于Al,所以Al作正极,而实验②中Al的活泼性大于Cu,所以Al作负极,所以实验①、②的Al所作的电极分别是:正极、负极,故d正确,
故答案为:d;
(2)实验③中Al为负极,电极反应为:2Al-6e-═2Al3+,
石墨为正极,其电极反应为:6H++6e-═3H2↑,
电池总反应为:2Al+6HCl═2AlCl3+3H2↑,
故答案为:2Al-6e-═2Al3+; 6H++6e-═3H2↑;
(3)根据表中实验结果可知,在原电池中电极作正极还是负极,与两个电极的相等活泼性有关,也与电解质溶液的酸碱性有关,
故答案为:两个电极的相对活泼性;电解质溶液的酸碱性;
(4)实验⑤中Al遇浓硝酸发生钝化,发生Cu与浓硝酸的氧化还原反应,Cu作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝,
故答案为:常温下在浓硝酸中,Al钝化作正极,铜易失电子作负极,所以电流计指针偏向铝.
点评 本题考查原电池原理、电极反应方程式的书写,题目难度中等,明确发生的原电池反应及正负极的判断是解答本题的关键,注意掌握利用氧化还原反应中化合价变化判断原电池的正负极的方法.

练习册系列答案
相关题目
1. (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
素材2:反应在不同条件下进行时SO2的转化率:
根据以上的两个素材回答问题:
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.
 (Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
(Ⅰ)用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:(1)实验过程如图所示,分析判断:EF段化学反应速率最快.
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是ACD
A.加入蒸馏水
B.加入浓盐酸
C.加入氯化钠溶液
D.降低反应体系的温度
(Ⅱ)以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,不同时间点测得密闭体系中三种物质的物质的量浓度:
| 时间(s) 物质的量浓度(mol/L) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强 转化率 温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.015mol/(L•s).
(2)根据素材2中分析得到,提高该化学反应限度的途径有降低温度、增大压强.
(3)若不考虑化学反应速率因素,仅根据素材2中分析,你认为硫酸厂能够取得最大经济效益需控制的反应条件是400℃、0.1MPa.
18.NA为阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2 L的戊烷所含的分子0.5NA | |
| B. | 28 g乙烯所含共用电子对数目为4NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为3 NA |
5.某实验小组的同学想用碳酸钠溶液与饱和石灰水反应来制取氢氧化钠.
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
(1)该复分解反应发生的理由是氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,有沉淀生成,该反应能够发生;
(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.
猜想一:只含NaOH;
猜想二:含有NaOH和Na2CO3;
猜想三:含有NaOH和Ca(OH)2.
(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格.可选试剂:NaCl溶液、稀盐酸、Na2CO3溶液
| 实验步骤 | 实验操作 | 预期现象及结论 |
| 1 | 取少量所得溶液于试管中, 再滴入几滴稀盐酸 | 若无气泡产生,证明原溶液中不含有Na2CO3 |
| 2 | 另取少量所得溶液于试管中, 再滴入几滴Na2CO3溶液 | 若无沉淀产生,结合步骤1,猜想一成立. |
14.下列关于钠元素的说法正确的是( )
| A. | 小苏打可以治疗胃酸过多,是利用了小苏打的酸性 | |
| B. | 与足量等浓度盐酸溶液反应的速率:NaHCO3<Na2CO3 | |
| C. | 久置在空气中的钠最后变成碳酸钠晶体 | |
| D. | 某未知样品灼烧时能使火焰呈黄色,说明该样品中肯定含有钠元素 |

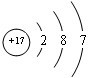 .
.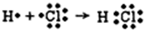 .
.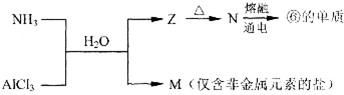
 NH4+
NH4+
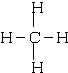 ; CO2O=C=O
; CO2O=C=O I.
I.

 .
.