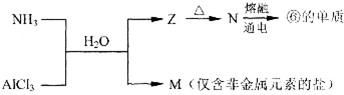
题目内容
10.下列实验误差分析错误的是( )| A. | 用湿润的pH试纸测稀溶液的pH,测定值可能偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏小 |
分析 A.pH试纸使用时不能湿润,湿润时不一定有误差,若测定酸的pH,可导致测定值偏大;
B.定容时俯视刻度线,水加少,则溶液体积偏小;
C.滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,则消耗的标准液偏小;
D.碱缓慢倒入酸中,不能准确测定反应的最高温度.
解答 解:A.pH试纸使用时不能湿润,湿润时不一定有误差,如湿润时测定NaCl的pH无影响,测定NaOH的pH偏小,测定HCl的pH时测定值偏大,故A正确;
B.定容时俯视刻度线,水加少,则溶液体积偏小,由c=$\frac{n}{V}$可知,所配溶液浓度偏大,故B错误;
C.滴定前滴定管尖嘴部分无气泡,终点读数时有气泡,则消耗的标准液偏小,由C标V标=C测V测可知,所测体积偏小,故C正确;
D.碱缓慢倒入酸中,不能准确测定反应的最高温度,热量损失导致所测温度值偏小,应一次性迅速将将碱倒入酸中,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及实验基本操作、溶液配制、滴定及中和热测定实验等,把握实验基本操作和基本技能为解答的关键,侧重分析与实验能力的考查,选项C为解答的易错点,题目难度不大.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
1.下列对于加成反应的说法中正确的是( )
| A. | 加成反应的结果是使有机化合物中不再含有不饱和键 | |
| B. | 福尔马林可以作为食品保鲜剂 | |
| C. | 甲苯在光照条件下与氯气反应,主要生成2,4-二氯甲苯 | |
| D. | 等物质的量的苯与苯甲酸完全燃烧消耗氧气的量相等 |
18.下列过程能实现热能转化为化学能的是( )
| A. | HCl十NaOH=NaCl十H2O | B. | 碳酸钙受热分解 | ||
| C. | 镁条溶于盐酸 | D. | CaO十H2O=Ca(OH)2 |
5.已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$的值与温度高低有关.当n(KOH)=amol时,下列有关说法错误的是( )
| A. | 改变温度,产物中KClO3的最大理论产量为$\frac{1}{7}$amol | |
| B. | 若某温度下,反应后$\frac{c(C{l}^{-})}{c(Cl{O}^{-})}$=11,则溶液中$\frac{c(Cl{O}^{-})}{c(Cl{O}_{3}^{-})}$=$\frac{1}{2}$ | |
| C. | 参加反应的氯气的物质的量等于$\frac{1}{2}$amol | |
| D. | 改变温度,反应中转移电子的物质的量ne的范围:$\frac{1}{2}$amol≤ne≤amol |
15.反应A+3B═2C+2D 在四种不同条件下的反应速率为:( )
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
(1)v(A)=0.3mol/(L•s )
(2)v(B)=0.6mol/(L•s)
(3)v(C)=0.4mol/(L•s)
(4)v(D)=0.45mol/(L•s)
| A. | (4)>(1)>(2)=(3) | B. | (2)>(1)>(4)=(3) | C. | (1)>(4)>(2)=(3) | D. | (3)>(4)>(2)=(1) |
2.下列说法正确的是( )
| A. | 常温下,0.1 mol/L的下列溶液①NH4Al(SO4)2;②NH4Cl;③NH3•H2O;④CH3COONH4⑤(NH4)2SO4中,c(NH4+)由大到小的顺序是:⑤>②>①>④>③ | |
| B. | 常温下,0.4 mol/L HB溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为:c(B-)>c(H+)>c(Na+)>c(OH-) | |
| C. | 常温下,将CH3COONa、HCl两溶液混合后,溶液呈中性,溶液中c(Na+)大于c(Cl-) | |
| D. | pH相等的下列溶液:a.CH3COOK、b.NaHCO3、c.Na2CO3、d.NaOH,其物质的量浓度由小到大顺序为:d<c<a<b |


 .
. .
.